sulforaphane er et fytokemikalie, et stof inden for isothiocyanatgruppen af organiske svovlforbindelser, som findes i korsblomstrede grøntsager, såsom broccoli, kål, blomkål og rosenkål. Den kan også findes i bok choy, grønkål, collards, sennepsgrønt og brøndkarse. Forskningsundersøgelser har vist, at sulforaphane kan hjælpe med at forebygge forskellige former for kræft ved aktivering af produktionen af Nrf2, eller nuklear faktor erythroid 2-relateret faktor, en transkriptionsfaktor, som regulerer beskyttende antioxidantmekanismer, der kontrollerer cellens respons på oxidanter. Formålet med den følgende artikel er at beskrive sulforafans funktion.
Indhold
Abstrakt
KEAP1-Nrf2-ARE antioxidantsystemet er et hovedmiddel, hvormed celler reagerer på oxidative og xenobiotisk stress. Sulforaphane (SFN), et elektrofilt isothiocyanat afledt af korsblomstrede grøntsager, aktiverer KEAP1-Nrf2-ARE-vejen og er blevet et molekyle af interesse i behandlingen af sygdomme, hvor kronisk oxidativt stress spiller en stor ætiologisk rolle. Vi demonstrerer her, at mitokondrierne af dyrkede, humane retinale pigmentepitelceller (RPE-1) behandlet med SFN gennemgår hyperfusion, der er uafhængig af både Nrf2 og dens cytoplasmatiske inhibitor KEAP1. Mitokondriel fusion er blevet rapporteret at være cytobeskyttende ved at hæmme poredannelse i mitokondrier under apoptose, og i overensstemmelse med dette viser vi Nrf2-uafhængig, cytobeskyttelse af SFN-behandlede celler udsat for apoptose-induceren, staurosporin. Mekanistisk mindsker SFN rekrutteringen og/eller tilbageholdelsen af den opløselige fissionsfaktor Drp1 til mitokondrier og til peroxisomer, men påvirker ikke den samlede Drp1-overflod. Disse data viser, at de gavnlige egenskaber ved SFN strækker sig ud over aktiveringen af KEAP1-Nrf2-ARE-systemet og berettiger yderligere forespørgsler i betragtning af den nuværende brug af dette middel i flere kliniske forsøg.
nøgleord: Sulforaphane, Nrf2, Drp1, Mitokondrier, Fission, Fusion, Apoptose
Introduktion
Sulforaphane er en Nrf2-uafhængig hæmmer af mitokondriel fission
Sulforaphane (SFN) er en isothiocyanatforbindelse, der er afledt i kosten oftest fra korsblomstrede grøntsager [56]. Det genereres i planter som en xenobiotisk reaktion på prædation via vesikulær frigivelse af det hydrolytiske enzym myrosinase fra beskadigede celler; dette enzym omdanner glucosinolater til isothiocyanter [42]. I løbet af de sidste to årtier er SFN i vid udstrækning blevet karakteriseret for dets rapporterede anticancer-, antioxidant- og antimikrobielle egenskaber [57]. Meget af denne effektivitet er blevet tilskrevet SFN's evne til at modulere KEAP1-Nrf2-antioxidant respons element (ARE) signalvejen, selvom yderligere aktiviteter af forbindelsen er blevet identificeret, herunder hæmning af histon deacetylase aktivitet og cellecyklus progression [ 29]. Nrf2 er hovedantioxidant-transkriptionsfaktoren, og under betingelser med homeostase undertrykkes dens stabilitet gennem virkningen af det cytoplasmatiske Cullin3KEAP1 ubiquitin-ligasekompleks [20]. Specifikt rekrutteres Nrf2 til Cullin3KEAP1-ligasen ved at binde til den dimere substratadapter KEAP1 og modificeres efterfølgende med polyUb-kæder, der målretter transkriptionsfaktoren for proteasom-medieret nedbrydning. Denne konstitutive omsætning begrænser halveringstiden for Nrf2 i ustressede celler til ~15 minutter [30], [33], [46], [55]. Som reaktion på adskillige typer stress, især oxidativ stress, fungerer KEAP1, et cysteinrigt protein, som en redoxsensor, og oxidativ modifikation af kritiske cysteiner, især C151, af KEAP1 dissocierer Nrf2-KEAP1 fra CUL3 og forhindrer derved Nrf2-nedbrydning [ 8], [20], [55]. Navnlig efterligner SFN og muligvis andre Nrf2-aktivatorer oxidativt stress ved at modificere C151 af KEAP1 f.eks. [21]. Stabilisering af Nrf2 muliggør dets translokation til kernen, hvor det inducerer ekspressionen af et batteri af fase II-antioxidant- og afgiftningsgener. Nrf2 binder sig til antioxidantresponspromotorelementerne (ARE) af dets beslægtede målgener gennem heterodimerisering med små Maf-proteiner [19]. Dette system præsenterer en dynamisk og følsom reaktion på indirekte antioxidanter som SFN, frie radikaler genereret af mitokondrierne [16] eller andre fysiologiske kilder til oxidativt stress [41].
Mitokondrier er dynamiske, subcellulære organeller, der regulerer et væld af cellulære funktioner lige fra ATP-produktion og intracellulær calciumbuffring til redoxregulering og apoptose [13], [49]. Mitokondrier repræsenterer også den vigtigste kilde til reaktive oxygenarter (ROS) i cellen. Korrekt regulering af mitokondriefunktionen er derfor nødvendig for at optimere ATP-produktionen for at imødekomme cellulære behov og samtidig minimere de potentielt skadelige virkninger af overdreven frie radikalproduktion. Et kritisk krav til finmodulering af mitokondriefunktion er mitokondriers evne til at fungere både uafhængigt som biokemiske maskiner og som en del af et stort, responsivt netværk.
Mitokondrielt netværks morfologi og funktion er bestemt af en reguleret balance mellem fission og fusion. Mitokondriel fission er påkrævet for dattercellearvning af mitokondrier under celledeling [28] såvel som for selektiv, autofagisk nedbrydning af depolariserede eller beskadigede mitokondrier, kaldet mitofagi [1]. Omvendt er fusion påkrævet for komplementering af mitokondrielle genomer og deling af elektrontransportkædekomponenter mellem nabomitokondrier [54]. På molekylært niveau reguleres mitokondriel fission og fusion af store, dynaminlignende GTPaser. Tre enzymer regulerer primært fusion: Mitofusin 1 og 2 (Mfn1/2) er to-pass ydre membranproteiner, der medierer ydre membranfusion via heterotypiske interaktioner mellem tilstødende mitokondrier [15], [25], [37], mens OPA1 er en indre membran. membranprotein, der samtidig sikrer matrixforbindelse ved at regulere sammensmeltningen af indre membraner [5]. GTPase-aktiviteten af alle tre proteiner er påkrævet for robust fusion [5], [18], og OPA1 reguleres yderligere af kompleks proteolyse inde i mitokondrernes indre membran af proteaserne OMA1 [14], PARL [6] og YME1L [45 ]. Det er vigtigt, at intakt mitokondriemembranpotentiale er påkrævet for effektiv fusion for at undertrykke integration af beskadigede og sunde mitokondrier [26].
Mitokondriel fission er primært katalyseret af et cytosolisk protein kaldet Dynamin-relateret protein 1 (Drp1/DNM1L). Drp1 rekrutteres fra cytosolen til potentielle fissionssteder på den mitokondrielle ydre membran [43]. De vigtigste receptorer for Drp1 på den ydre membran er mitokondriel fissionsfaktor (Mff) [32] og i mindre grad Fission 1 (Fis1) [51]. Derudover blev en lokkereceptor, MIEF1/MiD51, opdaget, der virker til yderligere at begrænse aktiviteten af Drp1-protein på potentielle fissionssteder [58]. Når først den er forankret ved den ydre mitokondriske membran, oligomeriseres Drp1 til spirallignende strukturer rundt om mitokondriets krop og bruger derefter energien afledt af GTP-hydrolyse til at mediere den fysiske spaltning af de mitokondrielle ydre og indre membraner [17]. Endoplasmatiske retikulum-afledte tubuli fungerer som en indledende sammensnøring af mitokondrier før Drp1-oligomerisering, hvilket understreger åbenbaringen, at ikke-indsnævrede mitokondrier er bredere end den tilladelige omkreds af en fuldført Drp1-spiral [12]. Aktin-dynamik er også vigtig for ER-mitokondrier-interaktioner, der går forud for mitokondriel fission [24]. Ud over sin rolle i mitokondriel fission katalyserer Drp1 fissionen af peroxisomer [40].
Drp1 ligner meget det velkarakteriserede dynaminprotein, idet begge proteiner indeholder et N-terminalt GTPase-domæne, et mellemdomæne, der er kritisk for selv-oligomerisering, og et C-terminalt GTPase-effektordomæne [31]. Drp1 opnår selektivitet for mitokondrielle membraner gennem en kombination af interaktioner med dets receptorproteiner Mff og Fis1 og også gennem dets affinitet for mitokondriespecifikke phospholipid cardiolipin via det unikke B-insert-domæne af Drp1 [2]. Drp1 eksisterer typisk som en homotetramer i cytoplasmaet, og samling af højere orden ved mitokondrielle fissionssteder medieres af det midterste domæne af Drp1 [3].
I betragtning af den implicitte forbindelse mellem mitokondriel funktion og KEAP1-Nrf2-ARE-vejen, undersøgte vi virkningerne af Nrf2-aktivering på mitokondriel struktur og funktion. Vi demonstrerer her, at SFN inducerer mitokondriel hyperfusion, der uventet er uafhængig af både Nrf2 og KEAP1. Denne effekt af SFN er gennem en hæmning af Drp1-funktionen. Vi demonstrerer yderligere, at SFN giver resistens over for apoptose, der er Nrf2-uafhængig og efterligner, som observeres i celler, der er udtømt for Drp1. Disse data tilsammen indikerer, at ud over at stabilisere og aktivere Nrf2, modulerer SFN mitokondriel dynamik og bevarer cellulær fitness og overlevelse.
Resultater
Sulforaphane inducerer Nrf2/KEAP1-uafhængig hyperfusion af mitokondrier
I løbet af undersøgelsen af virkningerne af Nrf2-aktivering på mitokondriel netværksdynamik opdagede vi, at behandling af udødeliggjorte, humane retinale pigmentepitelceller (RPE-1) med sulforaphane (SFN), en potent aktivator af Nrf2-signalering, inducerede en robust fusion af mitokondrielle netværk sammenlignet med vehikel-behandlede kontrolceller (fig. 1A og B). Morfologien af mitokondrierne i disse celler lignede i høj grad mitokondriernes morfologi i celler udtømt af siRNA af endogen Drp1, den vigtigste mitokondrielle fissionsfaktor (fig. 1A). Dette resultat rejste den spændende idé om, at mitokondriel fission og fusionsstatus reagerer direkte på Nrf2-niveauer i cellen. Stimulering af celler med andre Nrf2-stabilisatorer og -aktivatorer såsom proteasomhæmmeren MG132, pro-oxidanten tBHQ eller knockdown af Nrf2-hæmmeren KEAP1 inducerede imidlertid ikke mitokondriel fusion (fig. 1A og B). Stabilisering af Nrf2 ved disse manipulationer blev bekræftet ved western blotting for endogen Nrf2 (fig. 1C). Ydermere var ekspression af Nrf2 uundværlig for SFN-induceret mitokondriel fusion, da knockdown af endogen Nrf2 med siRNA ikke kunne modvirke denne fænotype (fig. 1D�F). Fordi SFN stimulerer KEAP1-Nrf2-ARE-vejen ved kovalent at modificere cysteinrester af KEAP1 [21], slog vi KEAP1 ned for at adressere, om SFN-induceret mitokondriel hyperfusion stimuleres gennem en KEAP1-afhængig, men Nrf2-uafhængig vej. Men udtømning af KEAP1 kunne heller ikke ophæve SFN-induceret mitokondriel fusion (fig. 1G�I). Faktisk vendte SFN profissionsmorfologien induceret af udtømning af KEAP1 (fig. 1G, panel b versus panel d). Disse resultater indikerer, at SFN-behandling forårsager mitokondriel fusion uafhængig af den kanoniske KEAP1-Nrf2-ARE-vej og førte os til at undersøge, om SFN direkte påvirker komponenter i mitokondriel fission eller fusionsmaskineri.
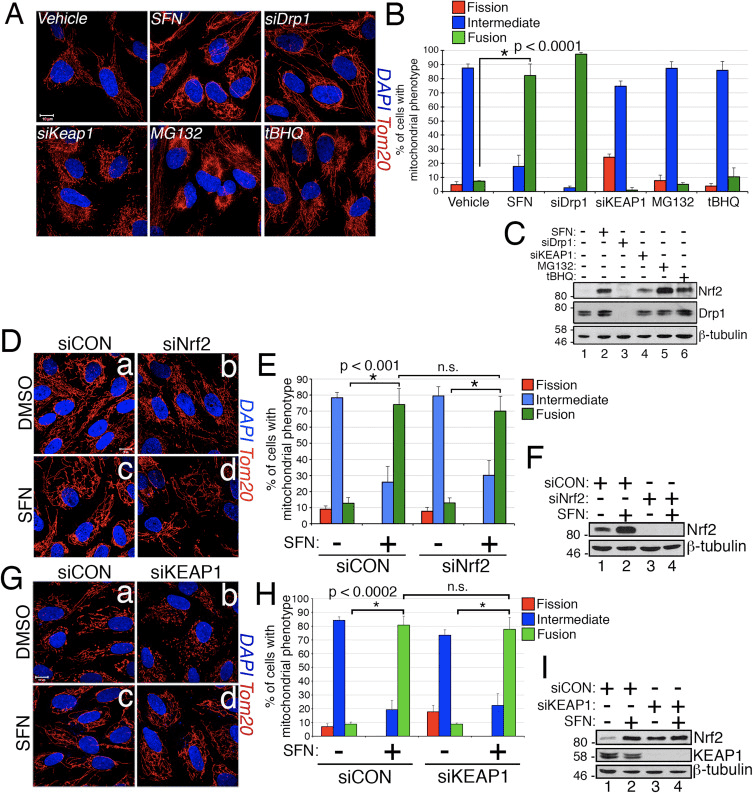
Sulforaphane hæmmer Mitochondrial Association of Drp1
Baseret på opdagelsen af, at SFN-behandling inducerer mitokondriel hyperfusion, begrundede vi, at denne fænotype enten var en konsekvens af overdreven fusionsaktivitet eller en hæmning af fissionsaktivitet. For at skelne mellem disse to muligheder sammenlignede vi morfologien af peroxisomer i nærvær og fravær af SFN. Peroxisomer ligner mitokondrier, idet de er dynamiske organeller, hvis form og længde konstant er i flux [44]. Peroxisomer indeholder både Fis1 og Mff i deres ydre membran og er som konsekvens mål for Drp1-medieret fission [22], [23]. Imidlertid udnytter peroxisomer ikke fusionsmaskineriet i mitokondrielle netværk og gennemgår derfor ikke fusion [39]. Snarere modvirkes peroxisomal fission af forlængelsen af eksisterende peroxisomer via de novo-tilsætning af membraner og proteiner [44]. Fordi peroxisomer mangler Mfn1/2 og OPA1, begrundede vi, at hvis SFN aktiverer fusionsmaskineriet i stedet for at hæmme fissionsmaskineriet, ville peroxisomlængden ikke blive påvirket. I vehikelbehandlede celler opretholdes peroxisomer som korte, runde, punktformede organeller (fig. 2, panel b og d). Imidlertid øgede SFN-behandling peroxisomlængden med ~2 gange sammenlignet med kontrolceller (fig. 2, paneler f og h). Ydermere blev mange af peroxisomerne klemt i nærheden af midten, hvilket indikerer en potentiel spaltningsdefekt (fig. 2, panel h, pilespidser). Ligeledes var peroxisomer i celler transficeret med Drp1 siRNA unormalt lange (fig. 2, paneler j og l), hvilket bekræfter, at Drp1 er påkrævet til peroxisomal fission og antyder, at SFN-behandling forårsager mitokondrielle og peroxisomale fænotyper ved at forstyrre fissionsmaskineriet.
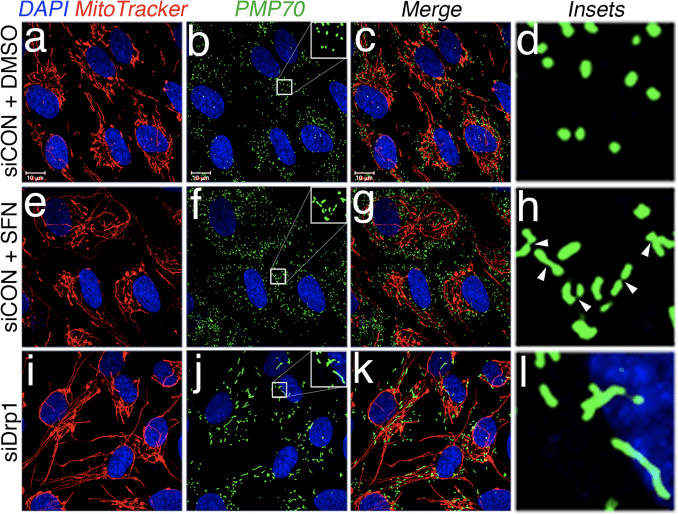
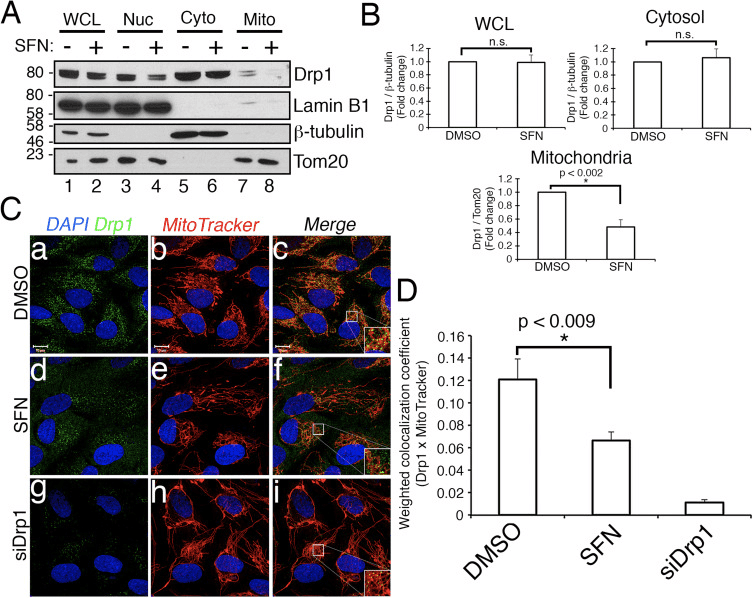
Vi bestemte derefter, hvordan SFN begrænser Drp1-funktionen. Mulighederne inkluderede reduktioner i ekspressionsniveauer, rekruttering/retention ved mitokondrier, oligomerisering eller enzymatisk aktivitet af GTPase. Et underskud i en af disse ville resultere i reduceret mitokondriel fission og hyperfusion. Vi påviste ikke reproducerbare ændringer i Drp1-proteinniveauer efter SFN-behandling (fig. 1C og 3A), og konkluderede derfor, at SFN ikke ændrer Drp1-stabilitet eller ekspression, hvilket stemmer overens med Drp1, der har en halveringstid på >10 timer [50] og vores SFN-behandlinger er af kortere varighed. Dernæst undersøgte vi, om SFN påvirkede rekrutteringen eller fastholdelsen af Drp1 til mitokondrier. Fraktioneringsundersøgelser viste, at SFN inducerede et tab af Drp1 fra mitokondriefraktionen (Fig. 3A, bane 7-8 og Fig. 3B). Som tidligere rapporteret [43] er kun en mindre brøkdel af Drp1 (~3%) forbundet med mitokondrielle netværk på et givet tidspunkt under steady state-betingelser med det meste af enzymet i cytoplasmaet (fig. 3A, bane 5-8) ). Disse fraktioneringsdata blev bekræftet ved hjælp af co-lokaliseringsanalyse, som viste en ~40% reduktion i mitokondrier-lokaliserede, punktformede Drp1-foci efter SFN-behandling (fig. 3C og D). Sammen indikerer disse data, at den mitokondrielle fusion induceret af SFN, i det mindste delvist, skyldes den svækkede association af Drp1 med mitokondrierne. Vores data skelner ikke mellem, om SFN interfererer med den mitokondrielle rekruttering versus den mitokondrielle tilbageholdelse af Drp1, eller begge dele, da analysen af endogen Drp1 ikke var egnet til at visualisere GTPase ved levende cellemikroskopi.
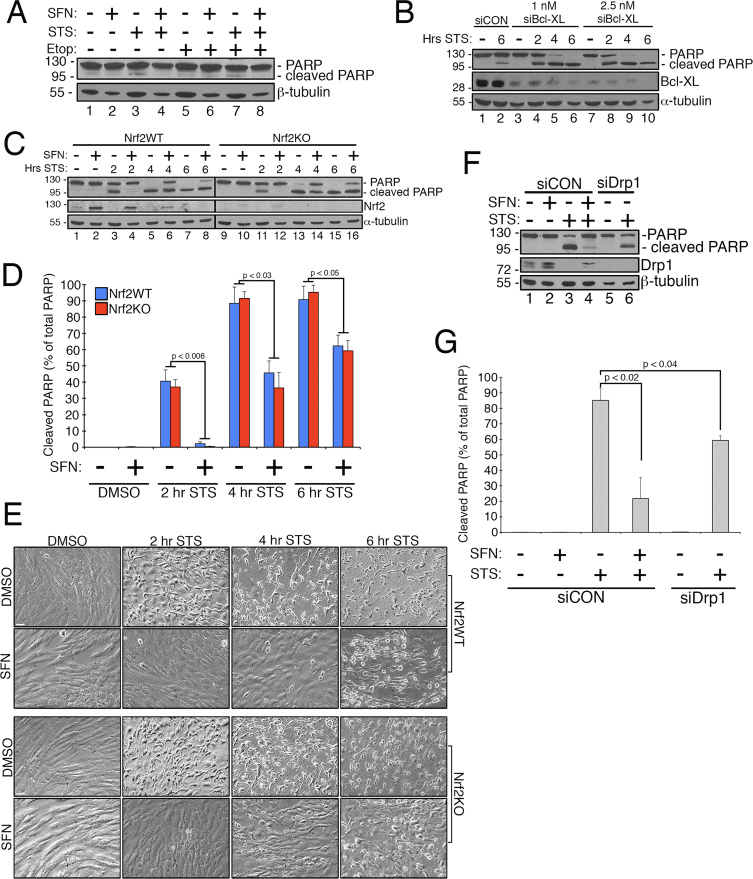
Sulforaphane giver beskyttelse mod staurosportin-induceret apoptose uafhængig af Nrf2
Tidligere arbejde har vist, at mitokondriel fission er permissiv i dannelsen af porer i den ydre mitokondrielle membran genereret af Bax/Bak under apoptose [11]. Drp1 har vist sig at blive selektivt rekrutteret til mitokondrier under apoptose [11], og i overensstemmelse med dette er fragmenterede mitokondrier blevet observeret tidligt i processen [27]. Omvendt menes inhibering af mitokondriel fission at hæmme apoptose ved at blokere dannelsen af de ydre membranporer, der tillader cytokrom c-frigivelse [53]. Følgelig forsinker stimulering af mitokondriel fusion progressionen af apoptose induceret af forbindelser, herunder staurosporin (STS) [14]. For at bestemme, om SFN beskytter RPE-1-celler mod STS-medieret apoptose, og i givet fald, om dette kræver Nrf2, etablerede vi et assay til let at inducere poly ADP-ribosepolymerase (PARP) spaltning, et substrat af aktiveret caspase-3 og definitiv markør for apoptose. Behandling af RPE-1-celler med 1 ¿M STS i 6 timer forårsagede kun en meget beskeden spaltning af PARP, men dette blev forhindret af SFN-sambehandling (f.eks. Fig. 4A, bane 3 versus 4). For at øge robustheden af dette assay sensibiliserede vi yderligere celler til STS-induceret apoptose ved at forbehandle dem med siRNA rettet mod den anti-apoptotiske faktor, Bcl-XL. Denne forbehandling reducerede ekspressionen af Bcl-XL og fremmede markant PARP-spaltning som funktion af tid udsat for STS (fig. 4B, sammenlign bane 2 med bane 4-10). Det er vigtigt, at 2 timers forbehandling med SFN mildnet PARP-spaltning i celler udsat for STS (fig. 4C, bane 3 versus 4 og bane 5 versus 6). Ligeledes blev celler stabilt udtømt for Nrf2 af CRISPR/Cas9 sammenligneligt beskyttet mod STS-toksicitet ved SFN-forbehandling (fig. 4C, bane 11 versus 12 og bane 13 versus 14 og fig. 4D). Denne beskyttelse blev observeret under anvendelse af både PARP-spaltning (fig. 4C og D) og cellulær morfologi (fig. 4E) som udlæsninger. Effektiviteten af Nrf2-depletering ved CRISPR/Cas9 blev bekræftet ved western blotting (fig. 4C, Nrf2 blot). Som forudsagt blokerede udtømmende celler af Drp1, som også giver en hyperfusionsfænotype (fig. 1A), også PARP-spaltning som svar på STS sammenlignet med kontrolceller inkuberet med SFN (fig. 4F og G). Tilsammen er disse resultater i overensstemmelse med SFN, der giver beskyttelse mod apoptose gennem dets evne til at begrænse Drp1-funktionen, uafhængigt af stabiliseringen og aktiveringen af Nrf2.
Diskussion
Vi har opdaget, at SFN modulerer mitokondriel fission/fusionsdynamik uafhængigt af dets virkninger på KEAP1-Nrf2-ARE-vejen. Dette er spændende på grund af en formodet sammenhæng mellem mitokondriel dysfunktion og ROS-produktion og nødvendigheden af at dæmpe mitokondrier-afledte frie radikaler gennem aktiveringen af Nrf2. Denne yderligere funktionelle virkning af SFN er af potentiel betydning i betragtning af de mere end 30 kliniske forsøg, der i øjeblikket er i gang med at teste SFN til behandling af en række sygdomme, herunder prostatacancer, obstruktiv lungesygdom og seglcellesygdom [7], [10], [ 47].
Fordi SFN er et isothiocyanat [56] og det aktiverer Nrf2-signalering ved direkte at acylere kritiske KEAP1-cysteiner for at undertrykke Nrf2-nedbrydning [21], følger det, at SFN udøver sine pro-fusionseffekter ved at modulere aktiviteten af en fissions- eller fusionsfaktor via cysteinmodifikation . Vores data understøtter kraftigt, at Drp1 er negativt reguleret af SFN, selvom om GTPase er et direkte mål for acylering, mangler at blive belyst. På trods af dette vidensgab bliver funktionen af Drp1 klart kompromitteret af SFN, da både mitokondrier og peroxisomer bliver hyperfusionerede som svar på SFN-behandling, og disse organeller deler Drp1 for deres respektive spaltningshændelser [38]. Derudover reducerer SFN mængden af Drp1, der lokaliseres og akkumuleres ved mitokondrier (fig. 3). Fordi vores eksperimenter blev udført med alle endogene proteiner, er vores påvisning af Drp1 på mitokondrielle fissionssteder under steady-state betingelser, og vi kan derfor ikke skelne mellem en rekruttering versus en retentionsdefekt af enzymet forårsaget af SFN. Yderligere kan vi ikke eliminere muligheden for, at SFN acylerer en receptor ved mitokondrierne (Fis1 eller Mff) for at blokere Drp1-rekruttering endnu, vi formoder, at Drp1 er direkte modificeret. Drp1 har ni cysteiner, hvoraf otte ligger inden for det midterste domæne, der er påkrævet til oligomerisering [3], og en af dem ligger i GTPase Effector Domain (GED) ved C-terminalen af Drp1. Direkte acylering af nogen af disse cysteiner kan forårsage en aktivitetsdefekt i Drp1 og ligger derfor til grund for virkningen af SFN på mitokondriel dynamik. Især tyder tidligere arbejde på, at defekter i oligomerisering og katalytisk aktivitet kan ophæve tilbageholdelsen af Drp1 ved mitokondrierne [52]. Cys644 i GED-domænet er et særligt attraktivt mål baseret på tidligere arbejde, der viser, at mutation af dette cystein fænokopierer mutationer, der hæmmer Drp1 GTPase-aktivitet [4], og at dette særlige cystein modificeres af thiol-reaktive elektrofiler [9]. Løsning af dette udestående spørgsmål vil kræve massespektrometrisk validering. Sammenfattende har vi identificeret en ny, cytobeskyttende funktion for den klinisk relevante forbindelse SFN. Ud over at aktivere master-antioxidant-transkriptionsfaktoren Nrf2, fremmer SFN mitokondriel og peroxisomal fusion, og denne effekt er uafhængig af Nrf2. Mekanismen bag dette fænomen involverer en reduktion i funktionen af GTPase Drp1, den primære mediator af mitokondriel og peroxisomal fission. En væsentlig konsekvens af SFN-medieret mitokondriel fusion er, at celler bliver resistente over for de toksiske virkninger af apoptoseinduceren staurosporin. Denne yderligere cytobeskyttende virkning af SFN kunne være af særlig klinisk nytte i de talrige neurodegenerative sygdomme, for hvilke alder er den førende risikofaktor (f.eks. Parkinsons sygdom, Alzheimers sygdom, aldersrelateret makuladegeneration), da disse sygdomme er blevet forbundet med apoptose og reduceret niveauer og/eller dysregulering af Nrf2 [35], [36], [48].
Materialer og Metoder
Apoptoseanalyser
Celler blev podet og transficeret med siRNA som angivet nedenfor. Cellerne blev forbehandlet med 50 µM sulforaphan i 2 timer for at inducere mitokondriel fusion og blev derefter behandlet med 1 µM staurosporin for at inducere apoptose. På høsttidspunktet blev medier opsamlet i individuelle rør og underkastet højhastighedscentrifugering for at pelletere apoptotiske celler. Denne cellepellet blev kombineret med adhærente celler og solubiliseret i 2 gange koncentreret Laemmli-buffer. Prøver blev udsat for anti-PARP western blotting.
CRISPR/Cas9 Construct Generation
For at skabe LentiCRISPR/eCas9 1.1 blev LentiCRISPR v2 (addgene #52961) først skåret med Age1 og BamH1. Dernæst blev SpCas9 fra eSpCas9 1.1 (addgen #71814) PCR-amplificeret med Age1- og BamH1-overhæng under anvendelse af følgende primere (Forward AGCGCACCGGTTCTAGAGCGCTGCCACCATGGACTATAAGGACCACGAC, Reverse AAGCGCGGATCCCTTTTTCTTTTTGGCC-vektoren skåret over i vektoren) og ligeret. sgRNA-sekvenser blev bestemt ved at bruge Benchling.com. Parametre blev sat til at målrette den kodende sekvens med den højeste on-target og laveste off-target score. De følgende sekvenser (targeting sekvens understregede, hs sgNFE2L2 # 1 sense CACCGCGACGGAAAGAGTATGAGC, antisense AAACGCTCATACTCTTTCCGTCGC; hs sgNFE2L2 # 2 sense CACCGGTTTCTGACTGGATGTGCT, antisense AAACAGCACATCCAGTCAGAAACC; hs sgNFE2L2 # 3 sense CACCGGAGTAGTTGGCAGATCCAC, antisense AAACGTGGATCTGCCAACTACTCC) blev annealet og ligeret ind BsmB1 skåret LentiCRISPR / eCas9 1.1. Lentiviralt inficerede RPE-1-celler blev udvalgt med puromycin og opretholdt som en poolet population. Knockout blev bekræftet ved immunfluorescens og western blotting.
Cellekultur og transfektioner
Humane retinale pigmentepitelceller transformeret med telomerase (RPE-1) (ATCC) blev dyrket i Dulbecco's Modified Eagle Medium (DMEM) indeholdende 1 g/L glucose suppleret med penicillin, streptomycin, 1X ikke-essentiel aminosyrecocktail (Life Technologies), og 10 % føtalt bovint serum (Life Technologies). Til siRNA-transfektioner blev 30,000-35,000 celler/ml podet natten over. Celler modtog 10 nM siRNA fortyndet i serumfrit DMEM og kombineret med 0.3 % interferintransfektionsreagens (PolyPlus). Til apoptosesensibilisering modtog celler 1 nM Bcl-XL siRNA. Celler blev høstet 2-3 dage efter transfektion.
Kemikalier, antistoffer og siRNA Oligos
Antistoffer mod β-tubulin (Cell Signaling), β-tubulin (Sigma), Drp1 (BD Biosciences), KEAP1 (Proteintech), Lamin B1 (Abcam), PARP (Cell Signaling), PMP70 (Abcam) og Tom20 (BD Biosciences) ) blev anvendt ved 1:1000 fortyndinger til western blotting og til immunfluorescens. In-house blev anti-Nrf2 kaninantistof brugt ved 1:2000 til western blotting [34], [59]. Sulforaphan (Sigma) og staurosporin (Tocris) blev anvendt ved henholdsvis 50 µM og 1 µM. siRNA'er mod Drp1 (Dharmacon), Nrf2 (Dharmacon), KEAP1 (cellesignalering) og Bcl-XL (cellesignalering) blev brugt ved 10 nM, medmindre andet er angivet.
Immunfluorescens og in vivo-mærkning
Celler podet på 18 mm glasdækglas blev behandlet med vehikel eller lægemiddel, fikseret i 3.7 % formaldehyd og derefter permeabiliseret i 0.2 % Triton X-100/PBS på is i 10 min. Primære antistoffer blev inkuberet i 3% bovint serumalbumin (BSA) i PBS natten over ved 4 °C. Efter PBS-vaske blev celler inkuberet i 1 time i artsegnede, Alexa488- eller Alexa546-, konjugerede sekundære antistoffer (fortyndet 1:1000) og 0.1 µg/ml DAPI (Sigma) i 3% BSA/PBS. Mitokondrier blev visualiseret enten ved anti-Tom20-immunfluorescens eller ved at inkubere celler i 200 nM MitoTracker Red CMXRos (Molecular Probes, Inc.) i serumfrit DMEM i 30 minutter ved 37 �C før fiksering.
Mikroskopi og billedanalyse
Immunofluorescensprøver blev set på et LSM710 Confocal mikroskop (Carl Zeiss). Mikrofotografier blev taget ved hjælp af 63X eller 100X olienedsænkningsmål og billeder justeret og forbedret ved hjælp af Adobe Photoshop CS6. Co-lokaliseringsanalyse blev udført ved hjælp af Carl Zeiss LSM710 co-lokaliseringsfunktion med tærskler manuelt indstillet, mens de var blindet for identiteten af prøverne. Skalabjælker overalt, medmindre andet er angivet, er 10 �m. Mitokondriel morfologi blev vurderet ved blindet scoring. Hvis mitokondrierne i en celle blev opretholdt som multiple, runde, diskriminerende puncta, blev cellen bedømt som �fission�. Hvis individuelle mitokondrier ikke kunne skelnes, og hele mitokondrielle netværk virkede kontinuerligt, blev cellen bedømt som �fusion�. Alle andre celler, inklusive dem med klyngede mitokondrier, blev bedømt som �mellemliggende�.
Subcellulære fraktioneringer
RPE-1-celler blev dyrket til konfluens. Efter en PBS-vask blev celler underkastet centrifugering ved 600 �g i 10 minutter og resuspenderet i 600 µl isoleringsbuffer (210 mM mannitol, 70 mM saccharose, 5 mM MOPS, 1 mM EDTA pH 7.4+1 mM PMSF). Suspensionen blev lyseret 30 gange i en Dounce-homogenisator. En fraktion af homogenatet blev konserveret som et helcellelysat. Resten blev underkastet centrifugering ved 800 �g i 10 minutter for at pelletere kerner. Supernatanter blev udsat for centrifugering ved 1500�g i 10 minutter for at fjerne resterende kerner og ulyserede celler. Denne supernatant blev udsat for centrifugering ved 15,000 �g i 15 minutter for at pelletere mitokondrier. Supernatanten blev bevaret som �cytosolfraktionen�. Pelleten blev vasket forsigtigt med PBS og resuspenderet i isoleringsbuffer. Proteinkoncentrationen af hver fraktion blev målt ved bicinchoninsyre (BCA) assay, og ækvivalente mængder af protein blev opløst ved SDS-PAGE.
Western Blotting
Celler blev vasket i PBS og solubiliseret i 2 gange koncentreret Laemmli solubiliseringspuffer (100 mM Tris [pH 6.8], 2 % SDS, 0.008 % bromphenolblåt, 2 % 2-mercaptoethanol, 26.3 % glycerol og 0.001 % Pyrinin Y). Lysater blev kogt i 5 minutter før påfyldning på natriumdodecylsulfat (SDS) polyacrylamidgeler. Proteiner blev overført til nitrocellulosemembraner, og membranerne blev blokeret i 1 time i 5% mælk/TBST. Primære antistoffer blev fortyndet i 5 % mælk/TBST og inkuberet med blottet natten over ved 4 °C. Peberrodsperoxidase (HRP)-konjugerede sekundære antistoffer blev fortyndet i 5 % mælk/TBST. Blots blev behandlet med forbedret kemiluminescens, og densitometriske kvantificeringer blev udført ved hjælp af ImageJ-software.

Sulforaphane er et kemikalie fra isothiocyanatsamlingen af organo-svovlstoffer opnået fra korsblomstrede grøntsager, herunder broccoli, kål, blomkål, grønkål og collards, blandt andre. Sulforaphane produceres, når enzymet myrosinase omdanner glucoraphanin, et glucosinolat, til sulforaphane, også kendt som sulforaphane-glucosinolat. Broccolispirer og blomkål har den højeste koncentration af glucoraphanin eller forstadiet til sulforaphane. Forskningsundersøgelser har vist, at sulforaphane forbedrer den menneskelige krops antioxidantevner for at forhindre forskellige sundhedsproblemer. Dr. Alex Jimenez DC, CCST Insight
Sulforaphane og dens virkninger på kræft, dødelighed, aldring, hjerne og adfærd, hjertesygdomme og mere
Isothiocyanater er nogle af de vigtigste planteforbindelser, du kan få i din kost. I denne video gør jeg det mest omfattende tilfælde til dem, der nogensinde er blevet lavet. Kort opmærksomhed span? Spring til dit yndlingsemne ved at klikke på et af nedenstående tidspunkter. Fuld tidslinje nedenfor.
Nøglesektioner:
- 00: 01: 14 - Kræft og dødelighed
- 00: 19: 04 - Aging
- 00: 26: 30 - Hjerne og adfærd
- 00: 38: 06 - Final recap
- 00: 40: 27 - Dosis
Fuld tidslinje:
- 00: 00: 34 - Introduktion af sulforaphane, et vigtigt fokus i videoen.
- 00: 01: 14 - Cruciferous vegetabilsk forbrug og reduktion af allårsag dødelighed.
- 00: 02: 12 - Prostatacancerrisiko.
- 00: 02: 23 - Kræftrisiko.
- 00: 02: 34 - Lungekræft i rygere risiko.
- 00: 02: 48 - Brystkræftrisiko.
- 00: 03: 13 - Hypotetisk: Hvad hvis du allerede har kræft? (Interventionel)
- 00: 03: 35 - Plausibel mekanisme, der driver kræft- og dødelighedsassosierende data.
- 00: 04: 38 - Sulforaphane og kræft.
- 00: 05: 32 - Dyrebevis, der viser stærk virkning af broccoli-spireekstrakt på udviklingen af blæretumor hos rotter.
- 00: 06: 06 - Virkning af direkte tilsætning af sulforaphan hos patienter med prostatacancer.
- 00: 07: 09 - Bioakkumulering af isothiocyanatmetabolitter i egentligt brystvæv.
- 00: 08: 32 - Inhibering af brystcancerstamceller.
- 00: 08: 53 - Historie lektion: brassicas blev etableret som at have sundhedsegenskaber selv i det gamle Rom.
- 00: 09: 16 - Sulforaphans evne til at øge kræftfremkaldende udskillelse (benzen, acrolein).
- 00: 09: 51 - NRF2 som en genetisk switch via antioxidant responselementer.
- 00: 10: 10 - Hvordan NRF2 aktivering øger kræftfremkaldende udskillelse via glutathion-S-konjugater.
- 00: 10: 34 - Spiraler øger glutathion-S-transferase og reducerer DNA-beskadigelse.
- 00: 11: 20 - Broccoli-spire drikker øger benzenudskillelsen med 61%.
- 00: 13: 31 - Broccoli spirehomogenat øger antioxidant enzymer i den øvre luftvej.
- 00: 15: 45 - Cruciferous vegetabilsk forbrug og dødelighed i hjertesygdomme.
- 00: 16: 55 - Broccoli spire pulver forbedrer blodlipider og overordnet hjertesygdomsrisiko hos type 2 diabetikere.
- 00: 19: 04 - Begyndelse af aldringssektionen.
- 00: 19: 21 - Sulforaphane beriget kost forbedrer levetiden for biller fra 15 til 30% (under visse forhold).
- 00: 20: 34 - Betydningen af lav inflammation for lang levetid.
- 00: 22: 05 - Cruciferous grøntsager og broccoli spire pulver synes at reducere et bredt udvalg af inflammatoriske markører hos mennesker.
- 00: 23: 40 - Mid-video recap: kræft, aldrende sektioner
- 00: 24: 14 - Musestudier tyder på, at sulforaphan kan forbedre adaptiv immunfunktion i alderdommen.
- 00: 25: 18 - Sulforaphane forbedrede hårvækst i en musmodel af skaldethed. Billede på 00: 26: 10.
- 00: 26: 30 - Begyndelse af hjerne- og adfærdssektionen.
- 00: 27: 18 - Effekt af broccoli-spireekstrakt på autisme.
- 00: 27: 48 - Virkning af glucoraphanin på skizofreni.
- 00: 28: 17 - Start af depression diskussion (sandsynlig mekanisme og undersøgelser).
- 00: 31: 21 - Mus undersøgelse ved hjælp af 10 forskellige modeller af stress-induceret depression viser sulforaphan på samme måde som fluoxetin (prozac).
- 00: 32: 00 - Undersøgelse viser direkte indtagelse af glucoraphanin hos mus er tilsvarende effektiv til forebyggelse af depression fra social nederlagsspændingsmodel.
- 00: 33: 01 - Begyndelsen af neurodegenerationsafsnittet.
- 00: 33: 30 - Sulforaphane og Alzheimers sygdom.
- 00: 33: 44 - Sulforaphane og Parkinsons sygdom.
- 00: 33: 51 - Sulforaphane og Hungtington's sygdom.
- 00: 34: 13 - Sulforaphane øger varmechokproteiner.
- 00: 34: 43 - Begyndelse af traumatisk hjerneskade.
- 00: 35: 01 - Sulforaphane injiceret umiddelbart efter, at TBI forbedrer hukommelsen (musestudie).
- 00: 35: 55 - Sulforaphane og neuronal plasticitet.
- 00: 36: 32 - Sulforaphane forbedrer læring som model af type II diabetes hos mus.
- 00: 37: 19 - Sulforaphane og duchenne muskeldystrofi.
- 00: 37: 44 - Myostatininhibering i muskel-satellitceller (in vitro).
- 00: 38: 06 - Late video recap: dødelighed og kræft, DNA-beskadigelse, oxidativ stress og betændelse, udslip af benzen, kardiovaskulær sygdom, type II diabetes, hjernens virkninger (depression, autisme, skizofreni, neurodegeneration), NRF2-pathway.
- 00: 40: 27 - Tanker om at finde ud af en dosis broccolispirer eller sulforaphane.
- 00: 41: 01 - Anecdoter på spiring hjemme.
- 00: 43: 14 - På tilberedningstemperaturer og sulforafanaktivitet.
- 00: 43: 45 - Gut-bakteriekonvertering af sulforaphan fra glucoraphanin.
- 00: 44: 24 - Tilskud fungerer bedre, når de kombineres med aktiv myrosinase fra grøntsager.
- 00: 44: 56 - Madlavningsteknikker og cruciferous grøntsager.
- 00: 46: 06 - Isothiocyanater som goitrogener.
Anerkendelser
Sciencedirect.com/science/article/pii/S2213231716302750
Hvordan fremstilles Sulforaphane?
Opvarmning reducerer epithiospecificerende proteinaktivitet og øger sulforafandannelse i broccoli
Abstrakt
Sulforaphane, et isothiocyanat fra broccoli, er en af de mest potente fødevareafledte anticarcinogener. Denne forbindelse er ikke til stede i den intakte grøntsag, men dannes snarere af dens glucosinolat-precursor, glucoraphanin, ved virkningen af myrosinase, et thioglucosidase-enzym, når broccolivæv knuses eller tygges. Imidlertid har en række undersøgelser vist, at sulforaphanudbyttet fra glucoraphanin er lavt, og at en ikke-bioaktiv nitrilanalog, sulforaphanitril, er det primære hydrolyseprodukt, når plantevæv knuses ved stuetemperatur. Nylige beviser tyder på, at i Arabidopsis styres nitrildannelse fra glucosinolater af et varmefølsomt protein, epithiospecifierprotein (ESP), en ikke-katalytisk cofaktor af myrosinase. Vores mål var at undersøge virkningerne af opvarmning af broccolibuketter og spirer på dannelsen af sulforaphane og sulforaphane nitril, for at bestemme, om broccoli indeholder ESP-aktivitet, og derefter at korrelere varmeafhængige ændringer i ESP-aktivitet, sulforaphan-indhold og bioaktivitet, som målt ved induktion af fase II afgiftningsenzym quinonreduktase (QR) i cellekultur. Opvarmning af friske broccolibuketter eller broccolispirer til 60 �C før homogenisering øgede samtidig dannelsen af sulforaphan og reduceret sulforaphannitrildannelsen. Et betydeligt tab af ESP-aktivitet sideløbende med faldet i dannelsen af sulforaphanitril. Opvarmning til 70 �C og derover mindskede dannelsen af begge produkter i broccolibuketter, men ikke i broccolispirer. Induktionen af QR i dyrkede musehepatom Hepa lclc7-celler gik parallelt med stigninger i sulforaphandannelse.

Forvarmning af broccolibuketter og spirer til 60 �C øgede den myrosinase-katalyserede dannelse af sulforaphane (SF) i vegetabilske vævsekstrakter betydeligt efter knusning. Dette var forbundet med fald i dannelsen af sulforaphanitril (SF Nitril) og aktiviteten af epithiospecificerende protein (ESP).
nøgleord: Broccoli, Brassica oleracea, Cruciferae, Kræft, Anticarcinogen, Sulforaphane, Sulforaphane Nitril, Epithiospecifier protein, Quinonreduktase
Som konklusion er sulforaphane et fytokemikalie, der findes i broccoli og andre korsblomstrede grøntsager. En ukontrolleret mængde oxidanter forårsaget af både interne og eksterne faktorer kan forårsage oxidativ stress i den menneskelige krop, som i sidste ende kan føre til en række sundhedsproblemer. Sulforaphane kan aktivere produktionen af Nrf2, en transkriptionsfaktor, der hjælper med at regulere beskyttende antioxidantmekanismer, der kontrollerer cellens reaktion på oxidanter. Omfanget af vores information er begrænset til kiropraktik og rygsøjlesundhedsproblemer. For at diskutere emnet, er du velkommen til at spørge Dr. Jimenez eller kontakte os på�915-850-0900 .
Kurateret af Dr. Alex Jimenez
Henvist fra: Sciencedirect.com

Yderligere emnediskussion: Akut rygsmerter
Rygsmerte er en af de mest udbredte årsager til handicap og ubesvarede arbejdsdage over hele verden. Rygsmerter tilskrives den næst hyppigste årsag til lægekontorbesøg, der kun er større end infektioner i de øvre luftveje. Ca. 80 procent af befolkningen vil opleve rygsmerter mindst én gang i hele deres liv. Rygsøjlen er en kompleks struktur, der består af knogler, led, ledbånd og muskler, blandt andet blødt væv. På grund af dette kan kvæstelser og / eller forværrede forhold, såsom herniated diske, kan i sidste ende føre til symptomer på rygsmerter. Sportsskader eller personskader er ofte den hyppigste årsag til rygsmerter, men nogle gange kan de enkleste bevægelser have smertefulde resultater. Heldigvis kan alternative behandlingsmuligheder, såsom kiropraktisk pleje, hjælpe lindring af rygsmerter ved brug af rygtilpasninger og manuelle manipulationer, der i sidste ende forbedrer smertelindring.

EKSTRA EKSTRA | VIGTIGT EMNE: Anbefalet El Paso, TX Kiropraktor
***
Oplysningerne heri om "Hvad er Sulforaphane?" er ikke beregnet til at erstatte et en-til-en-forhold med en kvalificeret sundhedsperson eller autoriseret læge og er ikke medicinsk rådgivning. Vi opfordrer dig til at træffe sundhedsbeslutninger baseret på din forskning og partnerskab med en kvalificeret sundhedsperson.
Bloginformation og diskussioner om omfang
Vores informationsomfang er begrænset til kiropraktik, muskuloskeletal, fysisk medicin, wellness, bidragende ætiologisk viscerosomatiske forstyrrelser inden for kliniske præsentationer, tilhørende somatovisceral refleks klinisk dynamik, subluksationskomplekser, følsomme helbredsproblemer og/eller funktionel medicin artikler, emner og diskussioner.
Vi giver og præsenterer klinisk samarbejde med specialister fra forskellige discipliner. Hver specialist er styret af deres faglige omfang af praksis og deres licensjurisdiktion. Vi bruger funktionelle sundheds- og velværeprotokoller til at behandle og understøtte pleje af skader eller lidelser i bevægeapparatet.
Vores videoer, indlæg, emner, emner og indsigt dækker kliniske forhold, problemstillinger og emner, der relaterer til og direkte eller indirekte understøtter vores kliniske anvendelsesområde.*
Vores kontor har med rimelighed forsøgt at give støttende citater og har identificeret den eller de relevante forskningsundersøgelser, der understøtter vores indlæg. Vi leverer kopier af understøttende forskningsundersøgelser tilgængelige for tilsynsråd og offentligheden efter anmodning.
Vi forstår, at vi dækker forhold, der kræver yderligere forklaring på, hvordan det kan hjælpe med en bestemt plejeplan eller behandlingsprotokol. derfor er du velkommen til at spørge for yderligere at diskutere emnet ovenfor Dr. Alex Jimenez, DC, eller kontakte os på 915-850-0900.
Vi er her for at hjælpe dig og din familie.
Blessings
Dr. Alex Jimenez A.D. MSACP, RN*, CCST, Ifmcp*, CIFM*, ATN*
Email: coach@elpasofunctionalmedicine.com
Licenseret som Doctor of Chiropractic (DC) i Texas & New Mexico*
Texas DC-licensnummer TX5807, New Mexico DC Licensnr. NM-DC2182
Licenseret som registreret sygeplejerske (RN*) in Florida
Florida-licens RN-licens # RN9617241 (Kontrol nr. 3558029)
Kompakt status: Multi-State Licens: Bemyndiget til at praktisere i 40 stater*
Dr. Alex Jimenez DC, MSACP, RN*CIFM*, IFMCP*, ATN*, CCST
Mit digitale visitkort






