1. HVEM. HVEM | Overvægt og fedme. www.who.int/gho/ncd/
risk_factors/overweight/da/index.html. Tilgået 29. januar 2015.
2. Visscher PM, Brown MA, McCarthy MI, Yang J. Fem års GWAS-opdagelse.
Am J Hum Genet. 2012;90:7�24.
3. Locke AE, Kahali B, Berndt SI, Justice AE, Pers TH, Day FR, et al. Genetisk
undersøgelser af body mass index giver ny indsigt i fedmebiologi. Natur.
2015; 518: 197 206.
4. Ling C, Del Guerra S, Lupi R, R�nn T, Granhall C, Luthman H, et al.
Epigenetisk regulering af PPARGC1A i humane type 2 diabetiske øer og
effekt på insulinsekretion. Diabetologia. 2008;51:615�22.
5. Van Dijk SJ, Molloy PL, Varinli H, Morrison JL, Muhlhausler BS. Epigenetik
og menneskelig fedme. Int J Obes (Lond). 2015;39:85�97.
6. Teh AL, Pan H, Chen L, Ong ML, Dogra S, Wong J, et al. Effekten af
genotype og in utero miljø på interindividuel variation hos nyfødte
DNA-methylomer. Genome Res. 2014;24:1064�74.
7. Olsson AH, Volkov P, Bacos K, Dayeh T, Hall E, Nilsson EA, et al. Gennemgående
sammenhænge mellem genetisk og epigenetisk variation indflydelse
mRNA-ekspression og insulinsekretion i humane pancreas-øer. PLoS
Genet. 2014;10:e1004735.
8. Grundberg E, Meduri E, Sandling JK, Hedman AK, Keildson S, Buil A, et al.
Global analyse af DNA-methyleringsvariation i fedtvæv fra tvillinger
afslører links til sygdomsassocierede varianter i distale regulatoriske elementer.
Am J Hum Genet. 2013;93:876�90.
9. Ronn T, Volkov P, Gillberg L, Kokosar M, Perfilyev A, Jacobsen AL, et al.
Indvirkning af alder, BMI og HbA1c-niveauer på det genom-brede DNA
methylerings- og mRNA-ekspressionsmønstre i humant fedtvæv
og identifikation af epigenetiske biomarkører i blod. Hum Mol Genet.
2015; 24: 3792 813.
10. Waterland RA, Michels KB. Epigenetisk udviklingsepidemiologi
oprindelseshypotese. Annu Rev Nutr. 2007;27:363�88.
11. McMillen IC, Rattanatray L, Duffield JA, Morrison JL, MacLaughlin SM, Gentili
S, et al. Den tidlige oprindelse af senere fedme: veje og mekanismer. Adv
Exp Med Biol. 2009;646:71�81.
12. Ravelli A, van der Meulen J, Michels R, Osmond C, Barker D, Hales C, et al.
Glucosetolerance hos voksne efter prænatal eksponering for hungersnød. Lancet.
1998; 351: 173 7.
13. McMillen IC, MacLaughlin SM, Muhlhausler BS, Gentili S, Duffield JL,
Morrison JL. Udviklingsmæssige oprindelse af voksen sundhed og sygdom: rollen som
perikonceptionel og føtal ernæring. Basic Clin Pharmacol Toxicol.
2008; 102: 82 9.
14. Zhang S, Rattanatray L, McMillen IC, Suter CM, Morrison JL. Periconceptionel
ernæring og tidlig programmering af et liv med fedme eller modgang. Prog
Biophys Mol Biol. 2011;106:307�14.
15. Bouret S, Levin BE, Ozanne SE. Gen-miljø interaktioner kontrollerende
energi- og glukosehomeostase og udviklingen af fedme.
Physiol Rev. 2015;95:47�82.
16. Borengasser SJ, Zhong Y, Kang P, Lindsey F, Ronis MJ, Badger TM, et al.
Maternel fedme øger hvidt fedtvævsdifferentiering og ændrer
DNA-methylering i genomskala hos hanrotteafkom. Endokrinologi.
2013; 154: 4113 25.
17. Gluckman PD, Lillycrop KA, Vickers MH, Pleasants AB, Phillips ES, Beedle AS,
et al. Metabolisk plasticitet under pattedyrs udvikling er retningsbestemt
afhængig af den tidlige ernæringstilstand. Proc Natl Acad Sci US A.
2007; 104: 12796 800.
18. Godfrey KM, Sheppard A, Gluckman PD, Lillycrop KA, Burdge GC, McLean C,
et al. Epigenetisk genpromotor-methylering ved fødslen er forbundet med
barnets senere overvægt. Diabetes. 2011;60:1528�34.
19. McMillen IC, Adam CL, Muhlhausler BS. Tidlig oprindelse af fedme:
programmering af appetitreguleringssystemet. J Physiol. 2005;565(Pt 1):9�17.
20. Begum G, Stevens A, Smith EB, Connor K, Challis JR, Bloomfield F, et al.
Epigenetiske ændringer i føtale hypothalamus energiregulerende veje er
forbundet med moderens underernæring og twinning. FASEB J.
2012; 26: 1694 703.
21. Ge ZJ, Liang QX, Hou Y, Han ZM, Schatten H, Sun QY, et al. Moderlig fedme
og diabetes kan forårsage DNA-methyleringsændring i spermatozoer af
afkom hos mus. Reprod Biol Endocrinol. 2014;12:29.
22. Jousse C, Parry L, Lambert-Langlais S, Maurin AC, Averous J, Bruhat A, et al.
Perinatal underernæring påvirker methyleringen og ekspressionen af leptinet
gen hos voksne: implikation for forståelsen af metabolisk syndrom.
FASEB J. 2011;25:3271�8.
23. Lan X, Cretney EC, Kropp J, Khateeb K, Berg MA, Penagaricano F, et al.
Moderens kost under graviditeten inducerer genekspression og DNA
methyleringsændringer i fostervæv hos får. Front Genet. 2013;4:49.
24. Li CC, Young PE, Maloney CA, Eaton SA, Cowley MJ, Buckland ME, et al.
Maternel fedme og diabetes inducerer latente metaboliske defekter og
udbredte epigenetiske ændringer i isogene mus. Epigenetik. 2013;8:602�11.
25. Lillycrop KA, Phillips ES, Jackson AA, Hanson MA, Burdge GC. Kostprotein
begrænsning af drægtige rotter inducerer og folinsyretilskud forhindrer
epigenetisk modifikation af hepatisk genekspression i afkommet. J Nutr.
2005; 135: 1382 6.
26. Radford EJ, Ito M, Shi H, Corish JA, Yamazawa K, Isganaitis E, et al. I utero
effekter. In utero underernæring forstyrrer den voksne sperm methylom
og intergenerationel metabolisme. Videnskab. 2014;345(80):1255903.
27. Suter M, Bocock P, Showalter L, Hu M, Shope C, McKnight R, et al.
Epigenomics: moderens fedtholdige diæteksponering i utero forstyrrer
perifer cirkadisk genekspression hos ikke-menneskelige primater. FASEB J.
2011; 25: 714 26.
28. Suter MA, Ma J, Vuguin PM, Hartil K, Fiallo A, Harris RA, et al. I utero
udsættelse for en maternell kost med højt fedtindhold ændrer den epigenetiske histonkode i en
murin model. Am J Obs Gynecol. 2014;210:463 e1�463 e11.
29. Tosh DN, Fu Q, Callaway CW, McKnight RA, McMillen IC, Ross MG, et al.
Epigenetik af programmeret fedme: ændring i IUGR rottehepatisk IGF1
mRNA-ekspression og histonstruktur i hurtig vs. forsinket postnatal
indhentningsvækst. Am J Physiol Gastrointest Lever Physiol.
2010;299:G1023�9.
30. Sandovici I, Smith NH, Nitert MD, Ackers-Johnson M, Uribe-Lewis S, Ito Y,
et al. Moderens kost og aldring ændrer den epigenetiske kontrol af en promotor
interaktion ved Hnf4a-genet i pancreas-øer hos rotter. Proc Natl
Acad Sci US A. 2011;108:5449�54.
31. Braunschweig M, Jagannathan V, Gutzwiller A, Bee G. Undersøgelser vedr.
transgenerationel epigenetisk respons ned ad hanlinjen hos F2-grise. PLoS
En. 2012;7, e30583.
32. Carone BR, Fauquier L, Habib N, Shea JM, Hart CE, Li R, et al. Faderligt
induceret transgenerationel miljøomprogrammering af metabolisk
genekspression hos pattedyr. Celle. 2010;143:1084�96.
33. Ost A, Lempradl A, Casas E, Weigert M, Tiko T, Deniz M, et al. Faderlig kost
definerer afkoms kromatintilstand og intergenerationel fedme. Celle.
2014; 159: 1352 64.
34. Mart�nez D, Pentinat T, Rib� S, Daviaud C, Bloks VW, Cebri� J, et al. I utero
underernæring hos hanmus programmerer leverlipidmetabolisme i anden generation
afkom, der involverer ændret Lxra DNA-methylering. Celle Metab.
2014; 19: 941 51.
35. Wei Y, Yang CR, Wei YP, Zhao ZA, Hou Y, Schatten H, et al. Faderligt
induceret transgenerationel arv af modtagelighed for diabetes i
pattedyr. Proc Natl Acad Sci US A. 2014;111:1873�8.
36. Grossniklaus U, Kelly WG, Kelly B, Ferguson-Smith AC, Pembrey M, Lindquist
S. Transgenerationel epigenetisk arv: hvor vigtig er den? Nat Rev
Genet. 2013;14:228�35.
37. Pembrey M, Saffery R, Bygren LO. Menneskelige transgenerationelle reaktioner på
erfaring i tidligt liv: potentiel indvirkning på udvikling, sundhed og
biomedicinsk forskning. J Med Genet. 2014;51:563�72.
38. Wolff GL, Kodell RL, Moore SR, Cooney CA. Maternal epigenetik og methyl
kosttilskud påvirker agouti-genekspression i Avy/a-mus. FASEB J.
1998; 12: 949 57.
39. Jirtle RL, Skinner MK. Miljøepigenomi og sygdomsmodtagelighed.
Nat Rev Genet. 2007;8:253�62.
40. Morgan HD, Sutherland HG, Martin DI, Whitelaw E. Epigenetisk arv kl.
agouti-locuset i musen. Nat Genet. 1999;23:314�8.
41. Cropley JE, Suter CM, Beckman KB, Martin DI. Kimlinje epigenetisk
modifikation af den murine A vy allel ved ernæringstilskud. Proc
Natl Acad Sci US A. 2006;103:17308�12.
42. Hoile SP, Lillycrop KA, Thomas NA, Hanson MA, Burdge GC. Kostprotein
begrænsning under F0-drægtighed hos rotter inducerer transgenerationelle ændringer i
det hepatiske transkriptom hos kvindelige afkom. PLoS One. 2011;6, e21668.
43. Multhaup ML, Seldin MM, Jaffe AE, Lei X, Kirchner H, Mondal P, et al. Musemenneske
eksperimentel epigenetisk analyse afslører kostmål og
genetisk ansvar for diabetiske fænotyper. Celle Metab. 2015;21:138�49.
44. Michels KB, Binder AM, Dedeurwaerder S, Epstein CB, Greally JM, Gut I, et al.
Anbefalinger til design og analyse af epigenom-dækkende
foreningsstudier. Nat Metoder. 2013;10:949�55.
45. Dayeh TA, Olsson AH, Volkov P, Almgren P, R�nn T, Ling C. Identifikation af
CpG-SNP'er forbundet med type 2-diabetes og differentiel DNA-methylering
i menneskelige pancreas-øer. Diabetologia. 2013;56:1036�46.
46. Relton CL, Davey Smith G. To-trins epigenetisk Mendelsk randomisering: en
strategi til at fastslå den kausale rolle af epigenetiske processer i pathways
til sygdom. Int J Epidemiol. 2012;41:161�76.
47. Liu Y, Aryee MJ, Padyukov L, Fallin MD, Hesselberg E, Runarsson A, et al.
Epigenom-dækkende associationsdata implicerer DNA-methylering som en
formidler af genetisk risiko ved reumatoid arthritis. Nat Biotechnol.
2013; 31: 142 7.
48. Yuan W, Xia Y, Bell CG, Yet I, Ferreira T, Ward KJ, et al. En integreret
epigenomisk analyse for type 2 diabetes modtagelighed loci hos monozygotiske
tvillinger. Nat Commun. 2014;5:5719.
49. Nitert MD, Dayeh T, Volkov P, Elgzyri T, Hall E, Nilsson E, et al. Virkningen af en
træningsintervention på DNA-methylering i skeletmuskulatur fra første grad
pårørende til patienter med type 2-diabetes. Diabetes. 2012;61:3322�32.
50. Gagnon F, Assi D, Carri A, Morange PE, Trgou�t DA. Robust validering af
methyleringsniveauer association på CPT1A locus med lipid plasma niveauer.
J Lipid Res. 2014;55:1189�91.
51. Demerath EW, Guan W, Grove ML, Aslibekyan S, Mendelson M, Zhou YH,
et al. Epigenom-wide association atudy (EWAS) af BMI, BMI-ændring og
taljeomkreds hos afroamerikanske voksne identificerer flere replikerede
loci. Hum Mol Genet. 2015:ddv161�.
52. Dick KJ, Nelson CP, Tsaprouni L, Sandling JK, Assi D, Wahl S, et al. DNA
methylering og kropsmasseindeks: en genom-dækkende analyse. Lancet.
2014; 6736: 1 9.
53. Su S, Zhu H, Xu X, Wang X, Dong Y, Kapuku G, et al. DNA-methylering af
LY86-genet er forbundet med fedme, insulinresistens og
betændelse. Twin Res Hum Genet. 2014;17:183�91.
54. Clarke-Harris R, Wilkin TJ, Hosking J, Pinkney J, Jeffery AN, Metcalf BS, et al.
PGC1? promotormethylering i blod ved 5�7 år forudsiger fedme fra
9 til 14 år (EarlyBird 50). Diabetes. 2014;63:2528�37.
55. Guay SP, Brisson D, Lamarche B, Biron S, Lescelleur O, Biertho L, et al.
ADRB3-genpromotor DNA-methylering i blod og visceralt fedt
væv er forbundet med metaboliske forstyrrelser hos mænd. Epigenomi.
2014; 6: 33 43.
56. Agha G, Houseman EA, Kelsey KT, Eaton CB, Buka SL, Loucks EB. Fedme er
forbundet med DNA-methyleringsprofil i fedtvæv. Int J Epidemiol.
2014: 1 11.
57. Irvin MR, Zhi D, Joehanes R, Mendelson M, Aslibekyan S, Claas SA, et al.
Epigenomdækkende associationsundersøgelse af fastende blodlipider i genetik af
lipidsænkende medicin og kostnetværksundersøgelse. Cirkulation. 2014;130:565�72.
58. Frazier-Wood AC, Aslibekyan S, Absher DM, Hopkins PN, Sha J, Tsai MY, et al.
Methylering ved CPT1A locus er forbundet med lipoprotein subfraktion
profiler. J Lipid Res. 2014;55:1324�30.
59. Pfeifferm L, Wahl S, Pilling LC, Reischl E, Sandling JK, Kunze S, et al. DNA
methylering af lipid-relaterede gener påvirker blodlipidniveauer. Circ Cardiovasc
Genet. 2015.
60. Petersen AK, Zeilinger S, Kastenmüller G, R�misch-Margl W, Brugger M, Peters
A, et al. Epigenetik møder metabolomics: en epigenom-dækkende sammenhæng
undersøgelse med blodserum metaboliske træk. Hum Mol Genet. 2014;23:534�45.
61. Hidalgo B, Irvin MR, Sha J, Zhi D, Aslibekyan S, Absher D, et al. Epigenomfattende
associationsundersøgelse af fastemål for glukose, insulin og HOMA-IR
i genetik af lipidsænkende lægemidler og kostnetværksundersøgelse. Diabetes.
2014; 63: 801 7.
62. Dayeh T, Volkov P, Sal� S, Hall E, Nilsson E, Olsson AH, et al. Genom-dækkende
DNA-methyleringsanalyse af humane pancreas-øer fra type 2-diabetikere
og ikke-diabetiske donorer identificerer kandidatgener, der påvirker insulin
sekretion. PLoS Genet. 2014;10, e1004160.
63. Nilsson E, Jansson PA, Perfilyev A, Volkov P, Pedersen M, Svensson MK, et al.
Ændret DNA-methylering og differentiel ekspression af gener, der påvirker
stofskifte og betændelse i fedtvæv fra forsøgspersoner med type 2
diabetes. Diabetes. 2014;63:2962�76.
64. Benton MC, Johnstone A, Eccles D, Harmon B, Hayes MT, Lea RA, et al. En analyse af DNA-methylering i humant fedtvæv afslører differentiel modifikation af fedmegener før og efter gastrisk bypass og vægt
tab. Gene. 2015;16:1�21.
65. Bateson P, Gluckman P. Plasticitet og robusthed i udvikling og
udvikling. Int J Epidemiol. 2012;41:219�23.
66. Feinberg AP, Irizarry RA, Feinberg AP, Irizarry RA. Evolution i sundhed og
medicin Sackler kollokvium: stokastisk epigenetisk variation som en kørsel
udviklingskraft, evolutionær tilpasning og sygdom. Proc Natl Acad
Sci US A. 2010;107(Suppl):1757�64.
67. Martino D, Loke YJ, Gordon L, Ollikainen M, Cruickshank MN, Saffery R, et al.
Longitudinel, genom-skala analyse af DNA-methylering i tvillinger fra fødslen
til 18 måneders alderen afslører hurtig epigenetisk ændring i det tidlige liv og parspecifikke
virkninger af uoverensstemmelse. Genom Biol. 2013;14:R42.
68. Tobi EW, Goeman JJ, Monajemi R, Gu H, Putter H, Zhang Y, et al. DNA
methyleringssignaturer forbinder prænatal hungersnød eksponering til vækst og
stofskifte. Nat Commun. 2014;5:5592.
69. Dominguez-Salas P, Moore SE, Baker MS, Bergen AW, Cox SE, Dyer RA, et al.
Moderens ernæring ved undfangelsen modulerer DNA-methylering af mennesker
metastabile epialleller. Nat Commun. 2014;5:3746.
70. Quilter CR, Cooper WN, Cliffe KM, Skinner BM, Prentice PM, Nelson L, et al.
Indvirkning på afkoms methyleringsmønstre af maternel svangerskabsdiabetes
mellitus og intrauterin væksthæmning tyder på almindelige gener og
veje forbundet med efterfølgende type 2-diabetesrisiko. FASEB J. 2014:1�12.
71. Morales E, Groom A, Lawlor DA, Relton CL. DNA-methyleringssignaturer i
navlestrengsblod forbundet med moderens svangerskabsforøgelse: resultater fra
ALSPAC-kohorten. BMC Res Notes. 2014;7:278.
72. Ruchat SM, Houde AA, Voisin G, St-Pierre J, Perron P, Baillargeon JP, et al.
Svangerskabsdiabetes mellitus påvirker epigenetisk overvejende gener
involveret i stofskiftesygdomme. Epigenetik. 2013;8:935�43.
73. Liu X, Chen Q, Tsai HJ, Wang G, Hong X, Zhou Y, et al. Moderlig
førforståelse body mass index og afkoms navlestrengsblod DNA
methylering: udforskning af sygdommens tidlige liv. Environ Mol
Mutagen. 2014;55:223�30.
74. Soubry A, Murphy SK, Wang F, Huang Z, Vidal AC, Fuemmeler BF, et al.
Nyfødte af overvægtige forældre har ændrede DNA-methyleringsmønstre kl
indprentede gener. Int J Obes (Lond). 2015;39:650�7.
75. Jacobsen SC, Br�ns C, Bork-Jensen J, Ribel-Madsen R, Yang B, Lara E, et al.
Effekter af kortvarig overfodring med højt fedtindhold på DNA i hele genomet
methylering i skeletmuskulaturen hos raske unge mænd. Diabetologia.
2012; 55: 3341 9.
76. Gillberg L, Jacobsen SC, R�nn T, Br�ns C, Vaag A. PPARGC1A DNA
methylering i subkutant fedtvæv hos personer med lav fødselsvægt�
virkningen af 5 dages overfodring med højt fedtindhold. Metabolisme. 2014;63:263�71.
77. Huang YT, Maccani JZJ, Hawley NL, Wing RR, Kelsey KT, McCaffery JM.
Epigenetiske mønstre hos vellykkede vægttabsvedligeholdere: en pilotundersøgelse. Int J
Obes (Lond). 2015;39:865�8.
78. Barres R, Kirchner H, Rasmussen M, Yan J, Kantor FR, Krook A, N�slund E,
Zierath JR. Vægttab efter gastrisk bypass-operation ved menneskelig fedme
omformer promotor-methylering. Cell Rep. 2013:1�8.
79. Ahrens M, Ammerpohl O, von Sch�nfels W, Kolarova J, Bens S, Itzel T, et al.
DNA-methyleringsanalyse ved ikke-alkoholisk fedtleversygdom tyder på
distinkte sygdomsspecifikke og remodeling signaturer efter fedmekirurgi.
Celle Metab. 2013;18:296�302.
80. Voisin S, Eynon N, Yan X, biskop DJ. Motionstræning og DNA-methylering
hos mennesker. Acta Physiol (Oxf). 2014;213:39�59.
81. Lindholm ME, Marabita F, Gomez-Cabrero D, Rundqvist H, Ekstr�m TJ,
Tegnér J, et al. En integrativ analyse afslører koordineret omprogrammering
af epigenomet og transkriptomet i human skeletmuskulatur efter
uddannelse. Epigenetik. 2014;9:1557�69.
82. Denham J, O�Brien BJ, Marques FZ, Charchar FJ. Ændringer i leukocytten
methylom og dets effekt på kardiovaskulære gener efter træning.
J Appl Physiol. 2014:jap.00878.2014.
83. Rowlands DS, Page RA, Sukala WR, Giri M, Ghimbovschi SD, Hayat I, et al.
Multi-omiske integrerede netværk forbinder DNA-methylering og miRNA med
skeletmuskelplasticitet til kronisk træning ved type 2 diabetisk fedme.
Fysiol Genomics. 2014;46:747�65.
84. Horvath S, Erhart W, Brosch M, Ammerpohl O, von Schonfels W, Ahrens M,
et al. Fedme fremskynder epigenetisk aldring af menneskelig lever. Proc Natl Acad
Sci. 2014;111:15538�43.
85. Alm�n MS, Nilsson EK, Jacobsson JA, Kalnina I, Klovins J, Fredriksson R, et al.
Genom-dækkende analyse afslører DNA-methyleringsmarkører, der varierer med
både alder og overvægt. Gene. 2014.;548:61�7
86. Houseman EA, Molitor J, Marsit CJ. Referencefri celleblandingsjusteringer
i analyse af DNA-methyleringsdata. Bioinformatik. 2014;30:1431�9.
87. Wells JC. En kritisk vurdering af hypotesen om prædiktiv adaptiv respons.
Int J Epidemiol. 2012;41:229�35.
88. Williams-Wyss O, Zhang S, MacLaughlin SM, Kleemann D, Walker SK, Suter
CM, et al. Embryonal og perikonceptionel underernæring i
får har forskellige virkninger på binyrens epigenotype, vækst og
udvikling. Am J Physiol Endocrinol Metab. 2014;307:E141�50.
89. Zhang S, Rattanatray L, Morrison JL, Nicholas LM, Lie S, McMillen IC.
Moderlig fedme og den tidlige oprindelse af fedme blandt børn: opvejning
fordelene og omkostningerne ved moderens vægttab i den perikonceptionelle
periode for afkommet. Exp Diabetes Res. 2011;2011:585749.
90. Zhang S, Williams-Wyss O, MacLaughlin SM, Walker SK, Kleemann DO, Suter
CM, et al. Moderens underernæring i den første uge efter undfangelsen
resulterer i nedsat ekspression af glukokortikoid receptor mRNA i
fravær af GR exon 17-hypermethylering i fosterets hypofyse på det seneste
drægtighed. J Dev Orig Heal Dis. 2013;4:391�401.
91. Lie S, Morrison JL, Williams-Wyss O, Suter CM, Humphreys DT, Ozanne SE,
et al. Periconceptionel underernæring programmerer ændringer i insulinsignalering
molekyler og mikroRNA'er i skeletmuskulatur i singleton- og tvillingefoster
får. Biol Reprod. 2014;90:5.
92. Van Straten EM, van Meer H, Huijkman NC, van Dijk TH, Baller JF, Verkade
HJ, et al. Føtal lever X-receptoraktivering inducerer akut lipogenese men
påvirker ikke plasmalipidrespons på en fedtrig diæt hos voksne mus. Am J
Physiol Endocrinol Metab. 2009;297:E1171�8.
93. Fernandez-Twinn DS, Alfaradhi MZ, Martin-Gronert MS, Duque-Guimaraes
DE, Piekarz A, Ferland-McCollough D, et al. Nedregulering af IRS-1 in
fedtvæv fra afkom af overvægtige mus programmeres cellautonomt
gennem post-transkriptionelle mekanismer. Mol Metab.
2014; 3: 325 33.
94. Waterland RA, Travisano M, Tahiliani KG. Kostinduceret hypermethylering kl
agouti levedygtig gul nedarves ikke transgenerationelt gennem hunnen.
FASEB J. 2007;21:3380�5.
95. Ge ZJ, Luo SM, Lin F, Liang QX, Huang L, Wei YC, et al. DNA-methylering i
oocytter og lever fra hunmus og deres afkom: virkninger af diætinduceret med højt fedtindhold
fedme. Env Heal Perspect. 2014;122:159�64.
96. Ollikainen M, Ismail K, Gervin K, Kyll�nen A, Hakkarainen A, Lundbom J, et al.
Genomomfattende blod-DNA-methyleringsændringer ved regulatoriske elementer
og heterokromatiske områder hos enæggede tvillinger, der er uenige for fedme
og leverfedt. Clin Epigenetics. 2015; 7: 1 13.








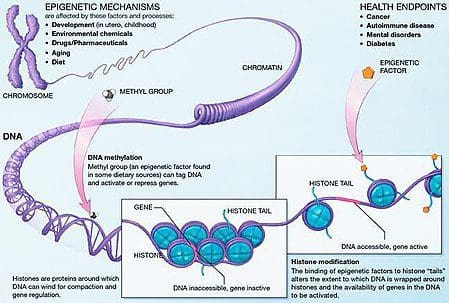 Fedme er en kompleks, multifaktorial sygdom, og bedre forståelse af mekanismerne bag interaktionerne mellem livsstil, miljø og genetik er afgørende for at udvikle effektive strategier til forebyggelse og behandling [1].
Fedme er en kompleks, multifaktorial sygdom, og bedre forståelse af mekanismerne bag interaktionerne mellem livsstil, miljø og genetik er afgørende for at udvikle effektive strategier til forebyggelse og behandling [1]. Dyremodeller giver unikke muligheder for stærkt kontrollerede undersøgelser, der giver mekanistisk indsigt i rollen af specifikke epigenetiske mærker, både som indikatorer for den aktuelle metaboliske status og som forudsigere for den fremtidige risiko for fedme og metabolisk sygdom. Et særligt vigtigt aspekt af dyreforsøg er, at de giver mulighed for vurdering af epigenetiske ændringer i målvæv, herunder leveren og hypothalamus, hvilket er meget vanskeligere hos mennesker. Desuden gør evnen til at høste store mængder frisk væv det muligt at vurdere flere kromatinmærker samt DNA-methylering. Nogle af disse epigenetiske modifikationer, enten alene eller i kombination, kan reagere på miljøprogrammering. I dyremodeller er det også muligt at studere flere generationer af afkom og dermed muliggøre differentiering mellem trans-generationel og intergenerationel overførsel af fedmerisiko medieret af epigenetisk hukommelse om forældrenes ernæringsstatus, som ikke let kan skelnes i menneskelige undersøgelser. Vi bruger førstnævnte betegnelse for meiotisk overførsel af risiko i fravær af fortsat eksponering, mens sidstnævnte primært indebærer direkte overførsel af risiko gennem metabolisk omprogrammering af fosteret eller kønscellerne.
Dyremodeller giver unikke muligheder for stærkt kontrollerede undersøgelser, der giver mekanistisk indsigt i rollen af specifikke epigenetiske mærker, både som indikatorer for den aktuelle metaboliske status og som forudsigere for den fremtidige risiko for fedme og metabolisk sygdom. Et særligt vigtigt aspekt af dyreforsøg er, at de giver mulighed for vurdering af epigenetiske ændringer i målvæv, herunder leveren og hypothalamus, hvilket er meget vanskeligere hos mennesker. Desuden gør evnen til at høste store mængder frisk væv det muligt at vurdere flere kromatinmærker samt DNA-methylering. Nogle af disse epigenetiske modifikationer, enten alene eller i kombination, kan reagere på miljøprogrammering. I dyremodeller er det også muligt at studere flere generationer af afkom og dermed muliggøre differentiering mellem trans-generationel og intergenerationel overførsel af fedmerisiko medieret af epigenetisk hukommelse om forældrenes ernæringsstatus, som ikke let kan skelnes i menneskelige undersøgelser. Vi bruger førstnævnte betegnelse for meiotisk overførsel af risiko i fravær af fortsat eksponering, mens sidstnævnte primært indebærer direkte overførsel af risiko gennem metabolisk omprogrammering af fosteret eller kønscellerne.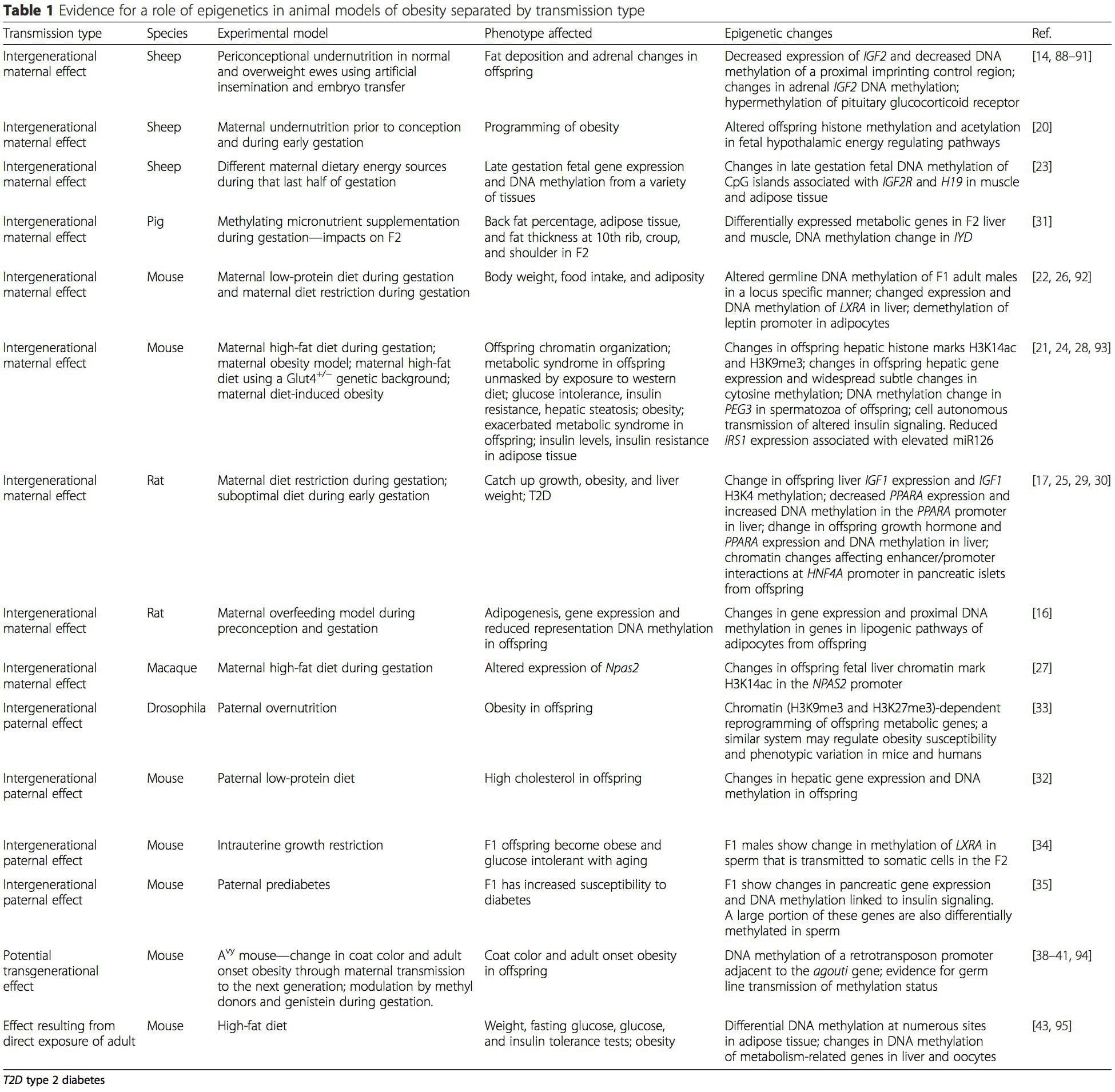 (i) Epigenetiske ændringer i afkom associeret med modernæring under svangerskabet
(i) Epigenetiske ændringer i afkom associeret med modernæring under svangerskabet Maternel ernæringstilskud, underernæring og overernæring under graviditeten kan ændre fedtaflejring og energihomeostase hos afkom [11, 13-15, 19]. Forbundet med disse effekter hos afkommet er ændringer i DNA-methylering, histon post-translationelle modifikationer og genekspression for flere målgener, især gener, der regulerer fedtsyremetabolisme og insulinsignalering [16, 17, 20-30]. Mangfoldigheden af dyremodeller brugt i disse undersøgelser og de almindelige påvirkede metaboliske veje tyder på en evolutionært bevaret adaptiv respons medieret af epigenetisk modifikation. Imidlertid er få af de specifikke identificerede gener og epigenetiske ændringer blevet krydsvalideret i relaterede undersøgelser, og storstilede genom-dækkende undersøgelser er typisk ikke blevet anvendt. En væsentlig hindring for sammenligning af disse undersøgelser er de forskellige udviklende mentale vinduer, der er udsat for ernæringsmæssige udfordringer, som kan forårsage betydeligt forskellige resultater. Der kræves også bevis for, at de epigenetiske ændringer er kausale snarere end at være forbundet med afkoms fænotypiske ændringer. Dette vil nødvendiggøre identifikation af et ernæringsmæssigt induceret epigenetisk hukommelsesrespons, der går forud for udviklingen af den ændrede fænotype hos afkom.
Maternel ernæringstilskud, underernæring og overernæring under graviditeten kan ændre fedtaflejring og energihomeostase hos afkom [11, 13-15, 19]. Forbundet med disse effekter hos afkommet er ændringer i DNA-methylering, histon post-translationelle modifikationer og genekspression for flere målgener, især gener, der regulerer fedtsyremetabolisme og insulinsignalering [16, 17, 20-30]. Mangfoldigheden af dyremodeller brugt i disse undersøgelser og de almindelige påvirkede metaboliske veje tyder på en evolutionært bevaret adaptiv respons medieret af epigenetisk modifikation. Imidlertid er få af de specifikke identificerede gener og epigenetiske ændringer blevet krydsvalideret i relaterede undersøgelser, og storstilede genom-dækkende undersøgelser er typisk ikke blevet anvendt. En væsentlig hindring for sammenligning af disse undersøgelser er de forskellige udviklende mentale vinduer, der er udsat for ernæringsmæssige udfordringer, som kan forårsage betydeligt forskellige resultater. Der kræves også bevis for, at de epigenetiske ændringer er kausale snarere end at være forbundet med afkoms fænotypiske ændringer. Dette vil nødvendiggøre identifikation af et ernæringsmæssigt induceret epigenetisk hukommelsesrespons, der går forud for udviklingen af den ændrede fænotype hos afkom. Nye undersøgelser har vist, at faderens ernæringsplan kan påvirke afkomfedtaflejring og epigenetiske mærker [31 34]. En nylig undersøgelse ved hjælp af mus har vist, at faderlig præ-diabetes fører til øget modtagelighed for diabetes hos F1-afkom med tilhørende ændringer i bugspytkirtelgenekspression og DNA-methylering forbundet med insulinsignalering [35]. Vigtigere var, at der var en overlapning af disse epigenetiske ændringer i bugspytkirteløer og sæd, hvilket antyder kimliniearv. Imidlertid er de fleste af disse undersøgelser, selvom de er spændende i deres implikationer, begrænsede i den genomiske undersøgelsesskala og viser ofte svage og noget forbigående epigenetiske ændringer forbundet med milde metaboliske fænotyper hos afkom.
Nye undersøgelser har vist, at faderens ernæringsplan kan påvirke afkomfedtaflejring og epigenetiske mærker [31 34]. En nylig undersøgelse ved hjælp af mus har vist, at faderlig præ-diabetes fører til øget modtagelighed for diabetes hos F1-afkom med tilhørende ændringer i bugspytkirtelgenekspression og DNA-methylering forbundet med insulinsignalering [35]. Vigtigere var, at der var en overlapning af disse epigenetiske ændringer i bugspytkirteløer og sæd, hvilket antyder kimliniearv. Imidlertid er de fleste af disse undersøgelser, selvom de er spændende i deres implikationer, begrænsede i den genomiske undersøgelsesskala og viser ofte svage og noget forbigående epigenetiske ændringer forbundet med milde metaboliske fænotyper hos afkom.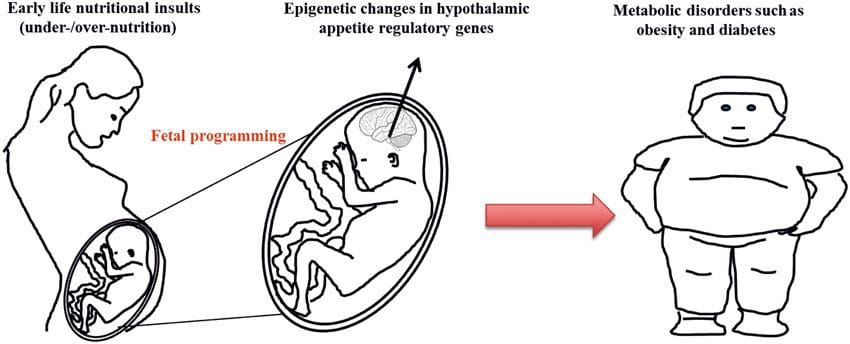 Stabil transmission af epigenetiske oplysninger på tværs af flere generationer er vel beskrevet i plante systemer og C. elegans, men dens betydning hos pattedyr er stadig meget omdiskuteret [36, 37]. Et epigenetisk grundlag for bedsteforældreoverførsel af fænotyper som reaktion på diæteksponering er blevet veletableret, herunder i husdyrarter [31]. De mest indflydelsesrige undersøgelser, der viser effekter af epigenetisk transmission, der påvirker afkoms fænotype, har brugt eksemplet med den levedygtige gule agouti (Avy) mus [38]. I denne mus forårsager en insertion af en retrotransposon opstrøms for agouti-genet dets konstitutive ekspression og deraf følgende gule pelsfarve og fedme fra voksne. Maternel transmission gennem kimlinjen resulterer i DNA-methyleringsmedieret dæmpning af agouti-ekspression, hvilket resulterer i vildtype pelsfarve og mager fænotype af afkommet [39, 40]. Det er vigtigt, at efterfølgende undersøgelser i disse mus viste, at moderens eksponering for methyldonorer forårsager et skift i pelsfarve [41]. En undersøgelse har rapporteret overførsel af en fænotype til F3-generationen og ændringer i ekspression af et stort antal gener som respons på proteinrestriktion i F0 [42]; Ændringer i ekspression var imidlertid meget varierende, og en direkte forbindelse til epigenetiske ændringer blev ikke identificeret i dette system.
Stabil transmission af epigenetiske oplysninger på tværs af flere generationer er vel beskrevet i plante systemer og C. elegans, men dens betydning hos pattedyr er stadig meget omdiskuteret [36, 37]. Et epigenetisk grundlag for bedsteforældreoverførsel af fænotyper som reaktion på diæteksponering er blevet veletableret, herunder i husdyrarter [31]. De mest indflydelsesrige undersøgelser, der viser effekter af epigenetisk transmission, der påvirker afkoms fænotype, har brugt eksemplet med den levedygtige gule agouti (Avy) mus [38]. I denne mus forårsager en insertion af en retrotransposon opstrøms for agouti-genet dets konstitutive ekspression og deraf følgende gule pelsfarve og fedme fra voksne. Maternel transmission gennem kimlinjen resulterer i DNA-methyleringsmedieret dæmpning af agouti-ekspression, hvilket resulterer i vildtype pelsfarve og mager fænotype af afkommet [39, 40]. Det er vigtigt, at efterfølgende undersøgelser i disse mus viste, at moderens eksponering for methyldonorer forårsager et skift i pelsfarve [41]. En undersøgelse har rapporteret overførsel af en fænotype til F3-generationen og ændringer i ekspression af et stort antal gener som respons på proteinrestriktion i F0 [42]; Ændringer i ekspression var imidlertid meget varierende, og en direkte forbindelse til epigenetiske ændringer blev ikke identificeret i dette system.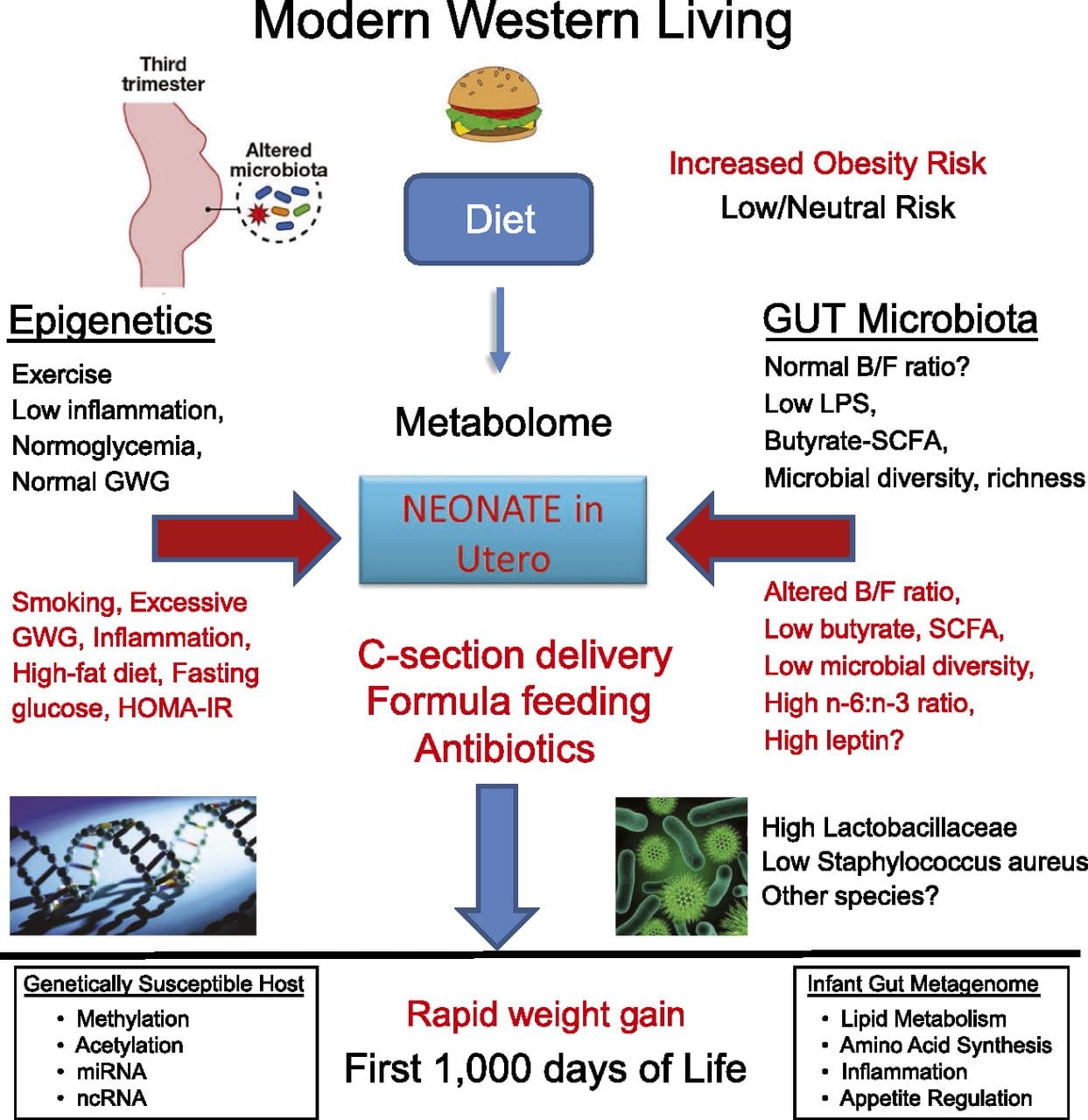 Selvom mange undersøgelser har identificeret diætassocierede epigenetiske ændringer i dyremodeller ved anvendelse af kandidatsitespecifikke regioner, er der blevet gennemført få genomgående analyser. En nylig undersøgelse fokuserede på at bestemme den direkte epigenetiske virkning af fedtholdige diæt / diætinduceret fedme hos voksne mus ved anvendelse af genomgående genekspression og DNA-methyleringsanalyser [43]. Denne undersøgelse identificerede 232 differentielt methylerede regioner (DMR'er) i adipocytter fra kontrol og fedmede fedmus. Vigtigt er de tilsvarende humane regioner for de murine DMR'er også differentielt methyleret i fedtvæv fra en population af overvægtige og magre mennesker og derved fremhæver den bemærkelsesværdige evolutionære bevarelse af disse regioner. Dette resultat understreger den sandsynlige betydning af de identificerede DMR i regulering af homeostase i pattedyr.
Selvom mange undersøgelser har identificeret diætassocierede epigenetiske ændringer i dyremodeller ved anvendelse af kandidatsitespecifikke regioner, er der blevet gennemført få genomgående analyser. En nylig undersøgelse fokuserede på at bestemme den direkte epigenetiske virkning af fedtholdige diæt / diætinduceret fedme hos voksne mus ved anvendelse af genomgående genekspression og DNA-methyleringsanalyser [43]. Denne undersøgelse identificerede 232 differentielt methylerede regioner (DMR'er) i adipocytter fra kontrol og fedmede fedmus. Vigtigt er de tilsvarende humane regioner for de murine DMR'er også differentielt methyleret i fedtvæv fra en population af overvægtige og magre mennesker og derved fremhæver den bemærkelsesværdige evolutionære bevarelse af disse regioner. Dette resultat understreger den sandsynlige betydning af de identificerede DMR i regulering af homeostase i pattedyr.
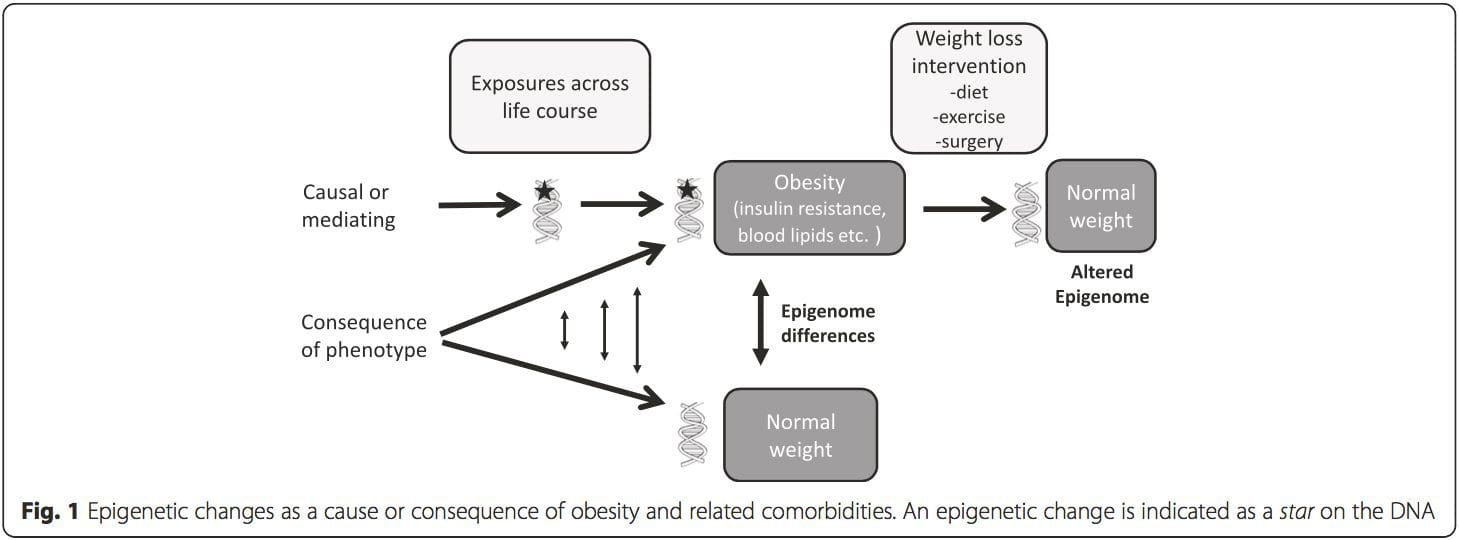 (i) Genetiske associeringsundersøgelser. Genetiske polymorfier, der er forbundet med en øget risiko for at udvikle særlige tilstande, er a priori knyttet til de forårsagende gener. Tilstedeværelsen af differentiel methylering i sådanne regioner infererer funktionel relevans af disse epigenetiske ændringer i at kontrollere ekspressionen af det eller de proksimale gener. Der er stærke cis-virkende genetiske effekter, der understøtter megen epigenetisk variation [7, 45], og i befolkningsbaserede undersøgelser er metoder, der bruger genetiske surrogater til at udlede en årsags- eller medierende rolle af epigenomforskelle, blevet anvendt [7, 46-48] . Brugen af familiær genetisk information kan også føre til identifikation af potentielt kausative kandidatregioner, der viser fænotype-relateret differentiel methylering [49].
(i) Genetiske associeringsundersøgelser. Genetiske polymorfier, der er forbundet med en øget risiko for at udvikle særlige tilstande, er a priori knyttet til de forårsagende gener. Tilstedeværelsen af differentiel methylering i sådanne regioner infererer funktionel relevans af disse epigenetiske ændringer i at kontrollere ekspressionen af det eller de proksimale gener. Der er stærke cis-virkende genetiske effekter, der understøtter megen epigenetisk variation [7, 45], og i befolkningsbaserede undersøgelser er metoder, der bruger genetiske surrogater til at udlede en årsags- eller medierende rolle af epigenomforskelle, blevet anvendt [7, 46-48] . Brugen af familiær genetisk information kan også føre til identifikation af potentielt kausative kandidatregioner, der viser fænotype-relateret differentiel methylering [49].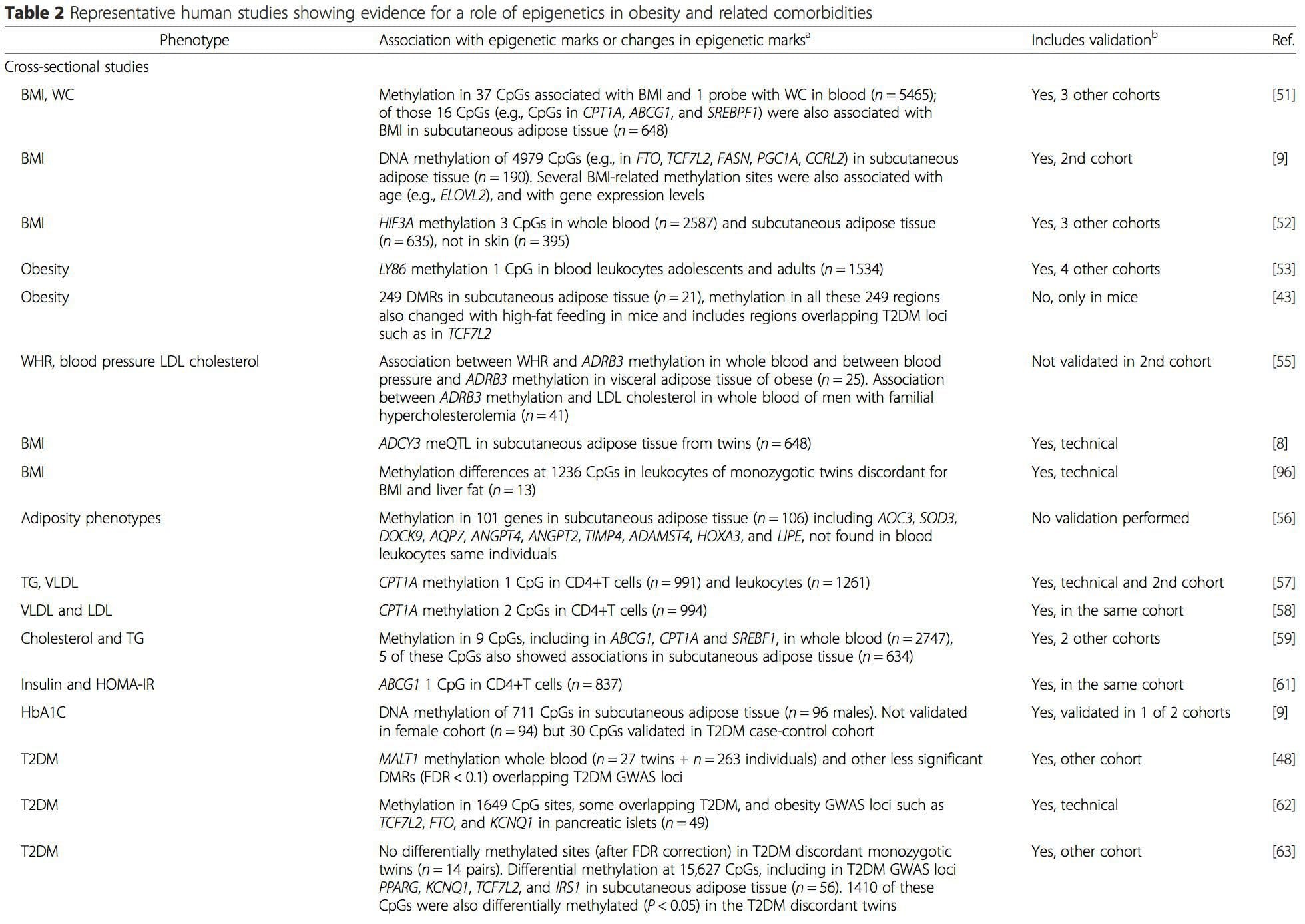
 Ud fra disse undersøgelser er ændret methylering af PGC1A, HIF3A, ABCG1 og CPT1A og den tidligere beskrevne RXRA [18] fremkommet som biomarkører forbundet med eller måske forudsigende for metabolisk sundhed, som også er sandsynlige kandidater til en rolle i udviklingen af metabolisk sygdom .
Ud fra disse undersøgelser er ændret methylering af PGC1A, HIF3A, ABCG1 og CPT1A og den tidligere beskrevne RXRA [18] fremkommet som biomarkører forbundet med eller måske forudsigende for metabolisk sundhed, som også er sandsynlige kandidater til en rolle i udviklingen af metabolisk sygdom .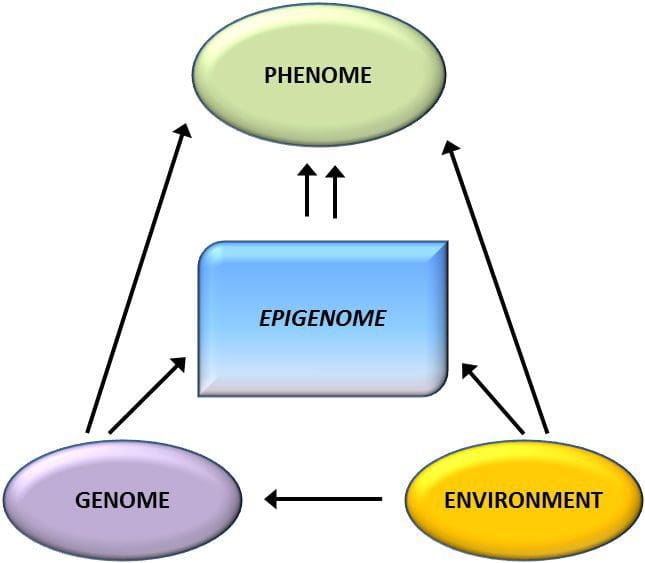 Epigenetisk variation er stærkt påvirket af den underliggende genetiske variation, med genotypen estimeret til at forklare ~20-40 % af variationen [6, 8]. For nylig er en række undersøgelser begyndt at integrere methylom- og genotypedata for at identificere methyleringskvantitative trait loci (meQTL) forbundet med sygdomsfænotyper. For eksempel er der i fedtvæv identificeret en meQTL, der overlapper med et BMI genetisk risikolocus i et forstærkerelement opstrøms for ADCY3 [8]. Andre undersøgelser har også identificeret overlapninger mellem kendt fedme og T2DM risiko loci og DMR'er forbundet med fedme og T2DM [43, 48, 62]. Methylering af en række af sådanne DMR'er blev også moduleret ved fodring med højt fedtindhold i mus [43] og vægttab hos mennesker [64]. Disse resultater identificerer en spændende sammenhæng mellem genetiske variationer forbundet med sygdomsmodtagelighed og deres sammenhæng med områder af genomet, der gennemgår epigenetiske modifikationer som reaktion på ernæringsmæssige udfordringer, hvilket indebærer en årsagssammenhæng. Den tætte forbindelse mellem genetisk og epigenetisk variation kan betyde deres væsentlige roller i at skabe individuel variation [65, 66]. Men mens disse resultater tyder på, at DNA-methylering kan være en mediator af genetiske effekter, er det også vigtigt at overveje, at både genetiske og epigenetiske processer kan virke uafhængigt på de samme gener. Tvillingundersøgelser [8, 63, 67] kan give vigtig indsigt og indikere, at inter-individuelle forskelle i niveauer af DNA-methylering hovedsageligt opstår fra ikke-delt miljø og stokastiske påvirkninger, minimalt fra fælles miljøpåvirkninger, men også med en betydelig påvirkning af genetiske variation.
Epigenetisk variation er stærkt påvirket af den underliggende genetiske variation, med genotypen estimeret til at forklare ~20-40 % af variationen [6, 8]. For nylig er en række undersøgelser begyndt at integrere methylom- og genotypedata for at identificere methyleringskvantitative trait loci (meQTL) forbundet med sygdomsfænotyper. For eksempel er der i fedtvæv identificeret en meQTL, der overlapper med et BMI genetisk risikolocus i et forstærkerelement opstrøms for ADCY3 [8]. Andre undersøgelser har også identificeret overlapninger mellem kendt fedme og T2DM risiko loci og DMR'er forbundet med fedme og T2DM [43, 48, 62]. Methylering af en række af sådanne DMR'er blev også moduleret ved fodring med højt fedtindhold i mus [43] og vægttab hos mennesker [64]. Disse resultater identificerer en spændende sammenhæng mellem genetiske variationer forbundet med sygdomsmodtagelighed og deres sammenhæng med områder af genomet, der gennemgår epigenetiske modifikationer som reaktion på ernæringsmæssige udfordringer, hvilket indebærer en årsagssammenhæng. Den tætte forbindelse mellem genetisk og epigenetisk variation kan betyde deres væsentlige roller i at skabe individuel variation [65, 66]. Men mens disse resultater tyder på, at DNA-methylering kan være en mediator af genetiske effekter, er det også vigtigt at overveje, at både genetiske og epigenetiske processer kan virke uafhængigt på de samme gener. Tvillingundersøgelser [8, 63, 67] kan give vigtig indsigt og indikere, at inter-individuelle forskelle i niveauer af DNA-methylering hovedsageligt opstår fra ikke-delt miljø og stokastiske påvirkninger, minimalt fra fælles miljøpåvirkninger, men også med en betydelig påvirkning af genetiske variation.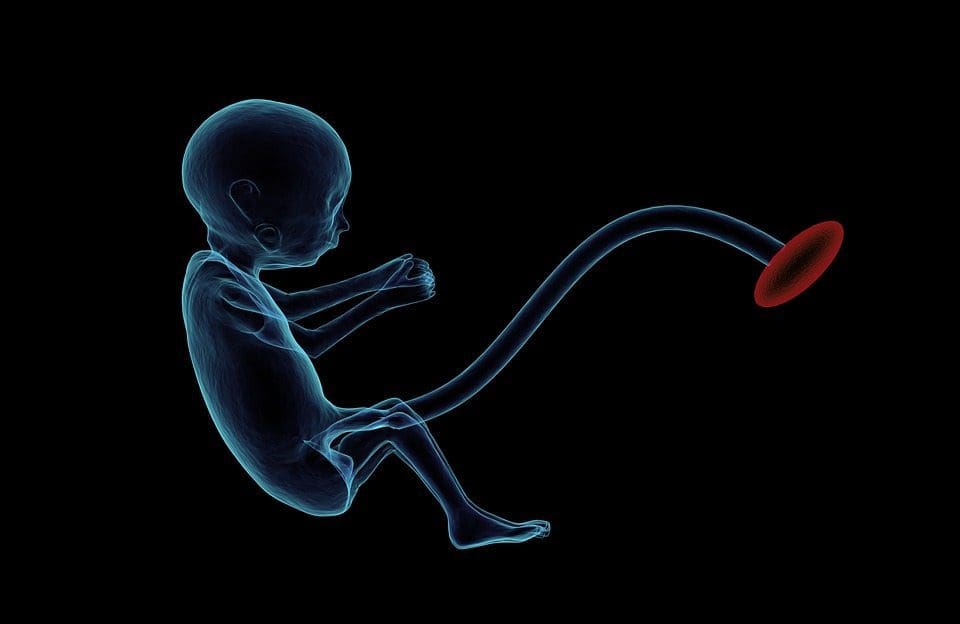 Prænatal miljø: To for nylig offentliggjorte undersøgelser anvendte menneskelige populationer, der oplevede naturlige variationer i næringsstofforsyning for at undersøge virkningen af moderens ernæring før eller under graviditet på DNA-methylering hos afkomene [68, 69]. Den første undersøgelse anvendte en gambisk mor-barn-kohorte for at vise, at både sæsonvariationer i moderens methylendonindtag under graviditet og moderens BMI før graviditet var forbundet med ændret methylering hos spædbørnene [69]. Den anden undersøgelse udnyttede voksne afkom fra den hollandske Hunger Winter-kohorte til at undersøge effekten af prænatal eksponering for en akut periode med alvorlig maternær underernæring på DNA-methylering af gener involveret i vækst og metabolisme i voksenalderen [68]. Resultaterne fremhævede vigtigheden af tidspunktet for eksponeringen i dens indvirkning på epigenomet, da signifikante epigenetiske effekter kun blev identificeret hos personer, der blev udsat for hungersnød under tidlig drægtighed. Vigtigere er, at de epigenetiske ændringer fandt sted i forbindelse med øget BMI; det var imidlertid ikke muligt at fastslå i denne undersøgelse, om disse ændringer var til stede tidligere i livet eller en konsekvens af det højere BMI.
Prænatal miljø: To for nylig offentliggjorte undersøgelser anvendte menneskelige populationer, der oplevede naturlige variationer i næringsstofforsyning for at undersøge virkningen af moderens ernæring før eller under graviditet på DNA-methylering hos afkomene [68, 69]. Den første undersøgelse anvendte en gambisk mor-barn-kohorte for at vise, at både sæsonvariationer i moderens methylendonindtag under graviditet og moderens BMI før graviditet var forbundet med ændret methylering hos spædbørnene [69]. Den anden undersøgelse udnyttede voksne afkom fra den hollandske Hunger Winter-kohorte til at undersøge effekten af prænatal eksponering for en akut periode med alvorlig maternær underernæring på DNA-methylering af gener involveret i vækst og metabolisme i voksenalderen [68]. Resultaterne fremhævede vigtigheden af tidspunktet for eksponeringen i dens indvirkning på epigenomet, da signifikante epigenetiske effekter kun blev identificeret hos personer, der blev udsat for hungersnød under tidlig drægtighed. Vigtigere er, at de epigenetiske ændringer fandt sted i forbindelse med øget BMI; det var imidlertid ikke muligt at fastslå i denne undersøgelse, om disse ændringer var til stede tidligere i livet eller en konsekvens af det højere BMI. Postnatal miljø: Epigenomet etableres de novo under embryonal udvikling, og derfor har det prænatale miljø sandsynligvis den mest betydningsfulde indvirkning på epigenomet. Imidlertid er det nu klart, at der forekommer ændringer i det ældre epigenom under indflydelse af en række betingelser, herunder aldring, eksponering for toksiner og diætændringer. For eksempel er ændringer i DNA-methylering i adskillige gener i skeletmuskulatur og PGC1A i fedtvæv blevet påvist som reaktion på en fedtfattig diæt [75, 76]. Interventioner for at tabe kropsfedtmasse har også været forbundet med ændringer i DNA-methylering. Undersøgelser har rapporteret, at DNA-methyleringsprofiler af fedtvæv [43, 64], perifere mononukleære blodceller [77] og muskelvæv [78] hos tidligere overvægtige patienter ligner mere profiler hos magre forsøgspersoner efter vægttab. Vægttabskirurgi vendte også delvist ikke-alkoholiske fedtleversygdomsassocierede methyleringsændringer i leveren [79] og i en anden undersøgelse førte til hypomethylering af multiple fedme-kandidatgener med mere markante effekter i subkutan sammenlignet med omental (visceralt) fedt [64] . Akkumulerende beviser tyder på, at træningsinterventioner også kan påvirke DNA-methylering. De fleste af disse undersøgelser er blevet udført hos magre individer [80 82], men en øvelsesundersøgelse hos overvægtige T2DM-forsøgspersoner viste også ændringer i DNA-methylering, herunder i gener involveret i fedtsyre- og glukosetransport [83]. Epigenetiske ændringer forekommer også med aldring, og nylige data tyder på, at fedme spiller en forøgelse af dem [9, 84, 85]. Fedme fremskyndede den epigenetiske alder af levervæv, men i modsætning til resultaterne beskrevet ovenfor var denne effekt ikke reversibel efter vægttab [84].
Postnatal miljø: Epigenomet etableres de novo under embryonal udvikling, og derfor har det prænatale miljø sandsynligvis den mest betydningsfulde indvirkning på epigenomet. Imidlertid er det nu klart, at der forekommer ændringer i det ældre epigenom under indflydelse af en række betingelser, herunder aldring, eksponering for toksiner og diætændringer. For eksempel er ændringer i DNA-methylering i adskillige gener i skeletmuskulatur og PGC1A i fedtvæv blevet påvist som reaktion på en fedtfattig diæt [75, 76]. Interventioner for at tabe kropsfedtmasse har også været forbundet med ændringer i DNA-methylering. Undersøgelser har rapporteret, at DNA-methyleringsprofiler af fedtvæv [43, 64], perifere mononukleære blodceller [77] og muskelvæv [78] hos tidligere overvægtige patienter ligner mere profiler hos magre forsøgspersoner efter vægttab. Vægttabskirurgi vendte også delvist ikke-alkoholiske fedtleversygdomsassocierede methyleringsændringer i leveren [79] og i en anden undersøgelse førte til hypomethylering af multiple fedme-kandidatgener med mere markante effekter i subkutan sammenlignet med omental (visceralt) fedt [64] . Akkumulerende beviser tyder på, at træningsinterventioner også kan påvirke DNA-methylering. De fleste af disse undersøgelser er blevet udført hos magre individer [80 82], men en øvelsesundersøgelse hos overvægtige T2DM-forsøgspersoner viste også ændringer i DNA-methylering, herunder i gener involveret i fedtsyre- og glukosetransport [83]. Epigenetiske ændringer forekommer også med aldring, og nylige data tyder på, at fedme spiller en forøgelse af dem [9, 84, 85]. Fedme fremskyndede den epigenetiske alder af levervæv, men i modsætning til resultaterne beskrevet ovenfor var denne effekt ikke reversibel efter vægttab [84].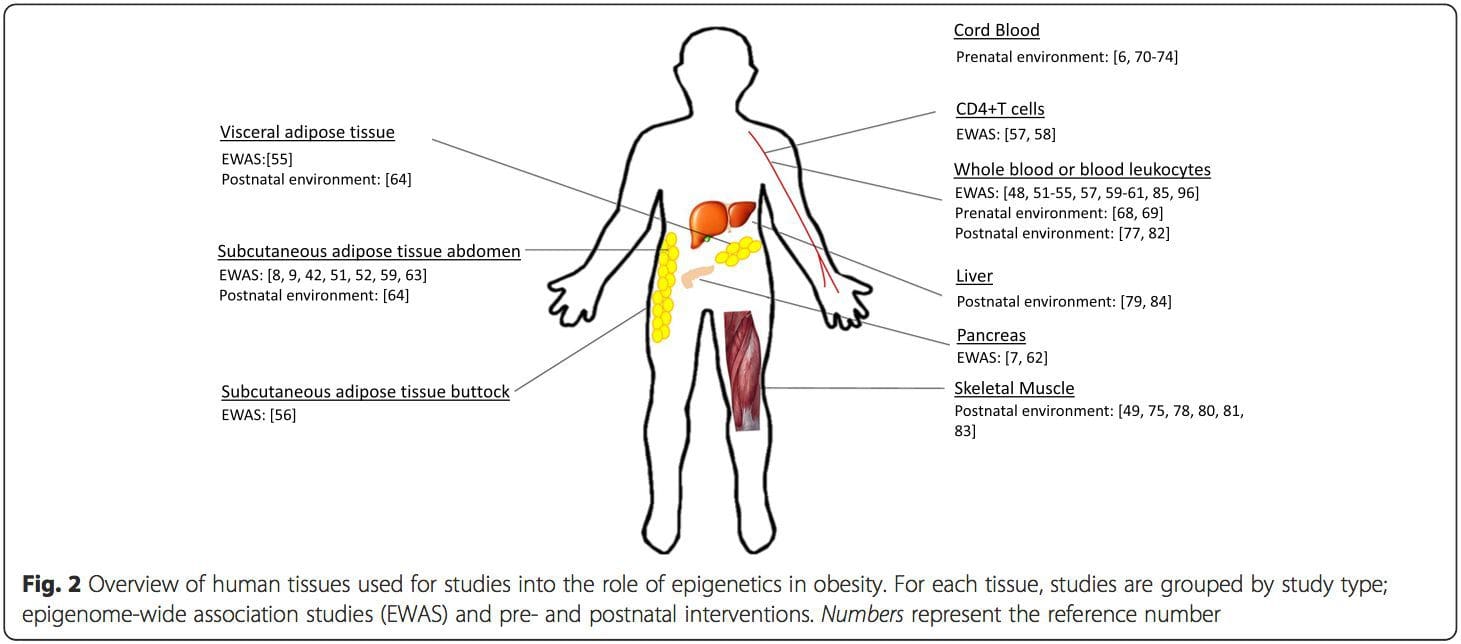 konklusioner
konklusioner



