Efter perifer nervetransektion af øvre lemmer og kirurgisk reparation genvinder nogle patienter en god sensorimotorisk funktion, mens andre ikke gør det. Forståelse af perifere og centrale mekanismer, der bidrager til bedring, kan lette udviklingen af nye terapeutiske interventioner. Plasticitet efter perifer nervetransektion er blevet påvist i hele neuroaksen i dyremodeller af nerveskade. Imidlertid er de hjerneændringer, der opstår efter perifer nervetransektion og kirurgisk reparation hos mennesker, ikke blevet undersøgt. Endvidere er det ikke blevet karakteriseret, i hvilket omfang perifer nerveregenerering påvirker funktionelle og strukturelle hjerneændringer. Derfor spurgte vi, om funktionelle ændringer er ledsaget af grå og/eller hvide substans strukturelle ændringer, og om disse ændringer relaterer sig til sensorisk restitution? For at løse disse nøgleproblemer har vi (i) vurderet perifer nerveregenerering; (ii) målt funktionel magnetisk resonansbilleddannende hjerneaktivering (blodiltniveauafhængigt signal; FED) som reaktion på en vibrotaktil stimulus; (iii) undersøgt grå og hvid substans strukturel hjerneplasticitet; og (iv) korrelerede sensoriske genopretningsforanstaltninger med ændringer i grå substans hos perifer nervetransektion og kirurgiske reparationspatienter. Sammenlignet med hver patients sunde kontralesionale nerve, har transsektionerede nerver nedsat nerveledning 1.5 år efter transektion og reparation, ledende med nedsat amplitude og øget latenstid. Sammenlignet med raske kontroller havde patienter med perifer nervetransektion og kirurgisk reparation ændret blodiltniveauafhængig signalaktivitet i de kontralæsionelle primære og sekundære somatosensoriske cortex og i et sæt hjerneområder kendt som det �task positive netværk�. Derudover blev der identificeret gråstofreduktioner i flere hjerneområder, inklusive de kontralæsionelle primære og sekundære somatosensoriske cortex, i de samme områder, hvor blodets iltniveauafhængige signalreduktioner blev identificeret. Ydermere var udtynding af gråt stof i den post-centrale gyrus negativt korreleret med mål for sensorisk genopretning (mekanisk og vibrationsdetektion), hvilket viser en klar sammenhæng mellem funktion og struktur. Endelig identificerede vi reduceret hvidt stof fraktioneret anisotropi i højre ø i et område, der også viste reduceret gråt stof. Disse resultater giver indsigt i hjernens plasticitet og struktur-funktion-adfærdsforhold efter nerveskade og har vigtige terapeutiske implikationer.
Nøgleord: kortikal tykkelse; fMRI; diffusion tensor billeddannelse; plasticitet; perifer nerveskade
Forkortelser: BA=Brodmann-området; BOLD=afhængig af iltniveau i blodet; fMRI=funktionel magnetisk resonansbilleddannelse;
PNIr = perifer nervetransektion og kirurgisk reparation; S1 = primær somatosensorisk cortex; S2=sekundær somatosensorisk cortex
Indhold
Introduktion
Efter perifer nervetransektion i øvre lemmer og kirurgisk reparation (PNIr) er 25 % af patienterne ikke vendt tilbage til arbejdet 1.5 år efter operationen (Jaquet et al., 2001). Derudover er 57 % af patienterne med nerveskader mellem 16-35 år (McAllister et al., 1996); således kan et langt liv med invaliditet og økonomiske vanskeligheder ledsage nervetransektion i øvre lemmer. Forståelse af de centrale og perifere konsekvenser af perifer nerveskade kan lette udviklingen af nye terapeutiske strategier og interventionsprogrammer.
Det vides ikke, hvordan hjernen reagerer på PNIr hos mennesker. Dyreforsøg har imidlertid fastslået, at plasticitet i den somatosensoriske cortex begynder umiddelbart efter perifer nervetransektion, og at 1 år efter fuldstændig nervetransektion og kirurgisk reparation indeholder kortikale kort plettede, ikke-kontinuerlige repræsentationer af de transsektionerede og tilstødende nerver (Wall et al. ., 1986). De mekanismer, der letter funktionel plasticitet, menes at omfatte den umiddelbare afsløring af allerede eksisterende projektioner fra tilstødende kortikale og subkortikale niveauer og langsigtet spiring af axoner på flere niveauer af neuroaksen, herunder den primære somatosensoriske cortex (S1) (Florence og Kaas) , 1995; Hickmott og Steen, 2005).
Billeddiagnostiske undersøgelser af menneskelig hjerne har bekræftet resultaterne fra dyremodeller med identifikation af ændrede funktionelle MRI-aktiveringskort på grund af rygmarvsskade, amputation, overførsel af tå til tommelfinger og hos patienter med karpeltunnelsyndrom (Lotze et al., 2001; Manduch et al., 2002; Jurkiewicz et al., 2006; Napadow et al., 2006). Desuden har strukturelle MR-undersøgelser for nylig visualiseret ændringer i grå og hvid substans efter traumatiske skader og under forskellige patologiske tilstande, herunder amputation af lemmer og kroniske smerter (Apkarian et al., 2004; Draganski et al., 2006; Davis et al., 2008; Geha et al., 2008; maj, 2008). Ændringer i grå substans menes at være relateret til ændringer i cellestørrelse, atrofi og/eller tab af neuroner eller glia, hvorimod ændringer i hvid substans påvirkes af aksonal degeneration og tab af myelin (Beaulieu, 2002; maj, 2008).
En kraftfuld tilgang til at afgrænse mekanismer for patologi og plasticitet er at kombinere funktionelle og strukturelle grå og hvide stof billeddannelsesteknikker. Vi har tidligere rapporteret, at patienter med komplet PNIr i øvre lemmer bevarede dybe somatosensoriske underskud, der vedvarer 41.5 år efter operationen (Taylor et al., 2008a). Baseret på disse resultater begrundede vi, at disse patienter ville udvise funktionelle og strukturelle hjerneændringer i centrale somatosensoriske hjerneområder. Derfor antog vi i denne undersøgelse, at PNIr-patienter ville have: (i) reducerede blodiltniveauafhængige (BOLD) reaktioner på vibrationsstimulering af det transsektionerede nerveterritorie, i området af S1, der repræsenterer det skadede øvre lem og i det sekundære somatosensorisk cortex (S2); (ii) en tilsvarende reduktion i kortikal tykkelse i disse områder af kontralæsionen S1 og S2; (iii) en sammenhæng mellem ændringer i kortikal tykkelse og psykofysiske mål for somatosensorisk funktion (vibrations- og berøringsdetektionstærskler); og (iv) reduceret fraktioneret anisotropi (et mål for hvidt stofs integritet) i hvidt stof, der fødes ind i/ud af disse somatosensoriske kortikale områder.
Metoder
Emner
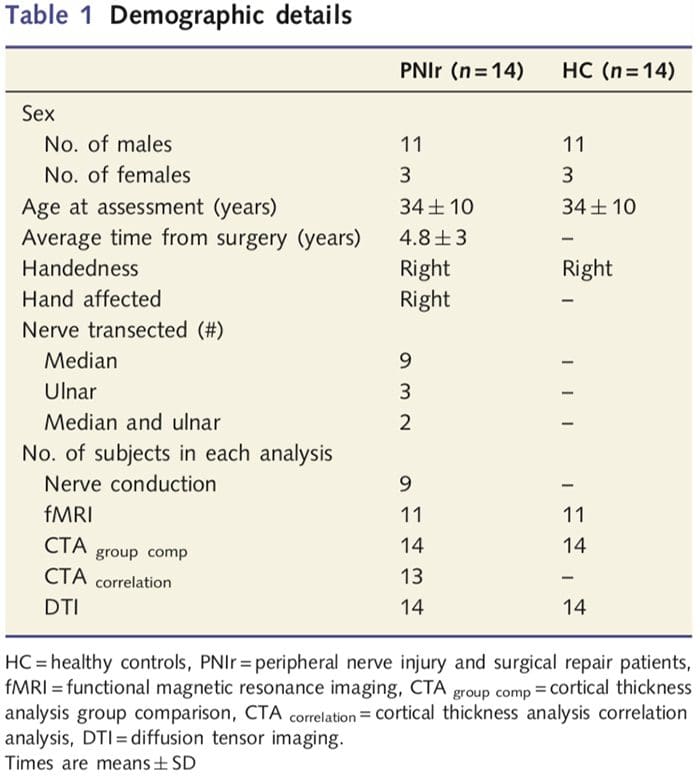
Vi rekrutterede 27 patienter med fuldstændig transektion af median- og/eller ulnarerven efterfulgt af kirurgisk reparation fra plastikkirurger tilknyttet University of Toronto Hand Program mellem juni 2006 og maj 2008. Fra denne større kohorte, 14 smertefrie patienter (tre kvinder , 11 mænd; 34 - 10 år) med fuldstændig transektion af højre median og/eller ulnar nerve blev inkluderet i undersøgelsen [for at undgå forvirring relateret til tilstedeværelsen af smerte- og lateralitetspatienter med smerte (n=6) og venstresidede læsioner (n=7) blev udelukket fra denne analyse]. Alle patienter gennemgik mikrokirurgisk nervereparation mindst 1.5 år før studieindskrivning (restitutionstiden varierede fra 1.5 til 8 år). Derudover rekrutterede vi 14 alders- og kønsmatchede sunde kontroller (3 kvinder, 11 mænd; 34 - 10 år). Alle forsøgspersoner gav informeret skriftligt samtykke til procedurer godkendt af University Health Network Research Ethics Board. Alle forsøgspersoner var højrehåndede (bestemt ved hjælp af Edinburgh-handedness-inventaret: Oldfield, 1971) og havde ingen historie med neurologisk skade eller kronisk smerte (hverken før eller efter nervetransektion). Se tabel 1 for demografiske detaljer.
Studere design
Alle forsøgspersoner deltog i en billeddiagnostisk session, der omfattede: (i) funktionel magnetisk resonansbilleddannelse (fMRI) som reaktion på vibrotaktile stimuli påført den højre pegefinger (inden for mediannerveterritoriet); (ii) en højopløsnings anatomisk scanning af hele hjernen, erhvervet til billedregistrering og til analyse af kortikalt gråt stof; og (iii) to diffusionstensorbilledscanninger til vurdering af hvidt stofs integritet. Forud for billeddannelsen blev forsøgspersonerne instrueret i eksperimentets grundlæggende design og mindet om at forblive så stille som muligt under hele scanningens varighed.
Forsøgspersoner kunne til enhver tid frit trække sig fra undersøgelsen. Derudover blev der foretaget en sensorisk og motorisk vurdering for alle forsøgspersoner (Taylor et al., 2008a). Da berørings- og vibrationsdetektionstærskler var korreleret med kortikal tykkelse, er en beskrivelse af disse metoder inkluderet nedenfor (andre psykofysiske foranstaltninger vil blive rapporteret andetsteds).
Vibrationstærskel
Vibrationsdetekteringstærskler blev bestemt ved hjælp af et håndholdt Bio-Thesiometer (Bio-Medical Instrument Company, USA). Enheden har en 12 mm sonde, der blev placeret på den distale phalanx af højre pegefinger (D2). Tærskler blev bestemt ved hjælp af grænsemetoden: amplituden (spændingen) blev gradvist øget, indtil forsøgspersonen angav, at de opfattede stimulus. Vibrationstærskler blev opnået tre gange, og en gennemsnitsværdi blev beregnet. Under test af vibrationstærskel blev forsøgspersonerne instrueret i at lukke øjnene og hvile håndryggen på en støttende pude.
Mekanisk detektionstærskel
Mekaniske detektionstærskler blev bestemt ved hjælp af et standardiseret sæt von Frey-filamenter (OptiHair2 Marstock Nervtest, Tyskland) indeholdende 12 logaritmisk adskilte kalibrerede filamenter, der leverede kræfter fra 0.25–512 mN. Kontaktfladediameteren af alle 12 filamenter var ~0.4 mm. Forsøg blev udført med forsøgspersonens øjne lukkede og hænder hvilende på en blød pude. Prober blev påført i en stigende serie, og forsøgspersoner blev forpligtet til at svare, hver gang de følte en sonde røre ved højre D2-fingerspids. Denne proces blev gentaget tre gange. Kraften for filamentet, der blev detekteret i mindst to ud af tre forsøg, blev rapporteret som det pågældende emnes mekaniske detektionstærskel.
Test af nerveledning
Patienter deltog i bilaterale sensoriske og motoriske nerveledningsundersøgelser på Toronto Western Hospital electromyography (EMG) klinik. Til motorisk nerveledning blev den stimulerende elektrode placeret ved håndled og albue (separat), og optagelseselektroden blev placeret over abductor pollicis brevis, til median nervevurdering, eller abductor digiti minimi til ulnar nervevurdering. Til sensorisk nervetestning blev registreringselektroden placeret ved håndleddet, og den stimulerende elektrode blev placeret ved cifrene D2, D3 og D5. En senior, erfaren neurolog fra Toronto Western Hospital EMG Clinic (Dr. Peter Ashby) gennemgik alle kliniske vurderinger for at bestemme, hvilke nerver der viste normale/unormale reaktioner. Da amplitude- og latensmålinger er kendt for at variere væsentligt mellem forsøgspersoner (på grund af faktorer såsom tætheden af innervation, dybden af nerven og tykkelsen af et individuelt individs hud) (Kimura, 2001) er hver patients ikke-transcuterede nerve tjente som deres egen kontrol til sammenligning med værdier fra den tværgående side. Hos de patienter med påviselige nerveledningsreaktioner blev der udført parrede t-tests for at vurdere forskellen i latens- eller amplitudemålinger mellem hver patients transsektionerede og kontralæsionelle utranssekerede nerver.
Billedbehandlingsparametre
Hjernebilleddata blev erhvervet ved hjælp af et 3T GE MRI-system udstyret med en otte-kanals phased array head coil. Forsøgspersonerne blev anbragt på ryggen på MRI-bordet, og hvert forsøgspersons hoved blev polstret for at reducere bevægelse. Helhjerne-fMRI-data blev indhentet ved hjælp af ekkoplanbilleddannelse (28 aksiale skiver, synsfelt (FOV) = 20 x 20 cm, 64 x 64 matrix, 3.125 x 3.125 x 4 mm voxels, ekkotid (TE) = 30 ms, gentagelse tid (TR) = 2000 ms). Scanningstiden var 5 min og 8 s (154 billeder). Under scanning blev en ikke-smertefuld, 12 Hz vibrotaktil stimulus påført den distale phalanx af højre D2 ved hjælp af ballonmembraner drevet af trykluft (Enhed fremstillet af Dr. Christo Pantev; www.biomag.uni-muenster.de). Stimuli blev afgivet i blokke på 10s interleaves med 20s hvile, for i alt 10 blokke af stimulering og 10 blokke af hvile. De første 8 s (4 TR'er) af data erhvervet fra hver kørsel blev kasseret for at muliggøre fMRI-signalækvilibrering. Forsøgspersonerne blev bedt om at holde øjnene lukkede under scanningen og fokusere på stimuli. En tredimensionel (3D) højopløsnings anatomisk scanning af hele hjernen (124 sagittale skiver, 24 x 24 cm FOV, 256 x� 256 matrix, 1.5 x 0.94 x 0.94 mm voxels) blev erhvervet med en T1-vægtet 3D-ekko-forkælet gradientsekvens. (gennemsnit af et signal, flip-vinkel = 20 µ, TE µ5 ms). Derudover blev to diffusionstensor-billedscanninger (38 aksiale skiver, FOV 24 x 24 cm, 128 x 128 matrix, 1.875 x 1.875 x 3 mm voxels) erhvervet langs 23 retninger med en b-værdi på 1000smm�2. Hver kørsel indeholdt også to volumener uden diffusionsvægtning.
fMRI-analyse
Data blev analyseret ved hjælp af Brainvoyager QX v1.8 (Brain Innovaton, Maastricht, Holland). Forbehandling inkluderet: 3D-bevægelseskorrektion, skivescanningstidskorrektion, lineær trendfjernelse, højpasfiltrering (fem cyklusser pr. kørsel) og rumlig udjævning med en 6 mm fuld bredde ved halv maksimum (FWHM) Gauss-kerne. fMRI-datasæt blev interpoleret til 3 x 3 x 3 mm voxels, registreret til det højopløselige anatomiske billede og normaliseret til standard Talairach-rum (Talairach og Tournoux, 1988). Voxel er rapporteret som 1 x 1 x 1 mm. Data blev analyseret ved hjælp af den generelle lineære model; modellen blev opnået ved at konvolvere boxcar-funktionen af tidsforløbet af taktil stimulering med den standard hæmodynamiske responsfunktion. For at identificere gruppeforskelle i aktiveringsmønstre blev der udført en fast effektanalyse med kontrasterne: (i) sunde kontroller: stimulation 4 hvile; (ii) PNIr: stimulation 4 hvile; og (iii) sunde kontroller 4 PNIr. Aktiveringskort blev tærskelværdier til en korrigeret værdi på P50.05 (afledt af en ukorrigeret P50.0001 og 120 mm3 sammenhængende voxels som tidligere rapporteret: Taylor og Davis, 2009); dette blev også valideret ved at køre en Monte Carlo Simulation med AlphaSim-applikation implementeret i Analysis of Functional Neuroimage (AFNI) software. Denne analyse inkluderede kun de 11 patienter, der vedblev transektion af højre medianusnerve (n=9) eller højre mediannerve og ulnarusnerve (n = 2) (dvs. de tre patienter med en ren højre ulnarervetransektion var ikke inkluderet i denne analyse ).
Kortikal tykkelsesanalyse
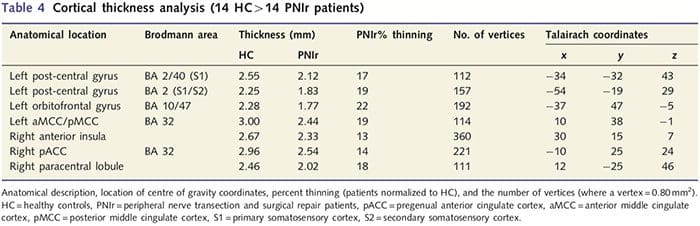
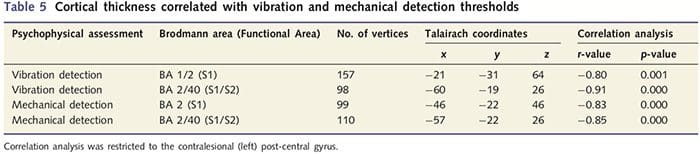
Kortikal tykkelsesanalyse blev udført under anvendelse af Freesurfer (http://surfer.nmr.mgh.harvard.edu); metoder er blevet beskrevet i detaljer andetsteds (Dale et al., 1999; Fischl et al., 1999a, b; Fischl og Dale 2000). Kort fortalt blev T1-vægtede anatomiske datasæt med høj opløsning registreret til Talairach-atlaset (Talairach og Tournoux, 1988). Dette blev efterfulgt af intensitetsnormalisering, kraniestripping og adskillelse af halvkuglerne. Efterfølgende blev grænserne for hvid/grå stof (kaldet hvid overflade) og grå/CSF (kaldet pial overflade) identificeret og segmenteret. Afstanden mellem den hvide og pial-overfladen blev derefter beregnet ved hvert punkt i hver hjernehalvdel. For at identificere gruppeforskelle mellem de 14 patienter og 14 alders-/kønsmatchede kontroller blev der udført en generel lineær modelanalyse på hvert punkt i hjernen. Da individets kortikale topografi i sagens natur er heterogen, blev en 5 mm FWHM rumlig udjævningskerne anvendt før statistisk analyse. Data vises ved en korrigeret P50.05 (afledt af en ukorrigeret P50.0075 og 102 sammenhængende hjørner); dette blev beregnet ved at køre en Monte Carlo-simulering med AlphaSim. Et toppunkt repræsenterer et punkt på et todimensionelt ark, og i denne undersøgelse er afstanden mellem to toppunkter 0.80 mm2.
Da patienter udviste betydelige underskud i somatosensorisk funktion inden for det transekserede nerveterritorium, antog vi, at målinger af somatosensorisk funktion (vibration og berøringsdetektion) ville korrelere med kortikal tykkelse i den kontralesionale post-centrale gyrus (primære og sekundære somatosensoriske cortex). Derfor udførte vi korrelationsanalyser i patientgruppen mellem: (i) kortikal tykkelse og vibrationsdetektionstærskel; og (ii) kortikal tykkelse og berøringsdetektionstærskler. En patient gennemførte ikke psykofysisk vurdering; derfor omfattede denne analyse 13 PNIr-patienter. For at afgøre, om der var en sammenhæng mellem kortikal tykkelse og restitutionstid, blev der også udført en korrelationsanalyse mellem disse to mål. Disse korrelationsanalyser blev begrænset til den kontralæsionelle post-centrale gyrus ved at inkludere en maske (taget fra Freesurfers indbyggede atlas) i den generelle lineære model. En Monte Carlo-simulering blev udført, der var begrænset til antallet af hjørner inden for kontralæsionel post-central gyrus; billeder vises med en korrigeret P50.05 (afledt af en ukorrigeret P50.0075 og 68 sammenhængende hjørner).
Diffusion Tensor Imaging Analyse
Diffusion tensor billedbehandling blev udført med DTiStudio (www.MriStudio.org) og FSLv.4.0 (www.fmrib.ox.ac.uk/fsl/). Billeder blev først justeret med værktøjet Automatic Image Registration implementeret i DTiStudio, ved at bruge det første B0-billede i den første serie, der blev erhvervet som skabelon. Denne proces korrigerer for motivbevægelse og hvirvelstrømsforvrængning. Alle billeder blev derefter inspiceret visuelt for at vurdere billedkvaliteten og justeringen af de separate diffusionstensorbilledkørsler. Hvis en artefakt blev detekteret, blev skiven fjernet før beregning af gennemsnittet af de to separate diffusionstensorbilledkørsler. Individuelle FA-kort blev beregnet ved hjælp af DTIFIT-værktøjet implementeret i FSL. Voxel-vis statistisk analyse blev udført for at identificere gruppeforskelle i den gennemsnitlige fraktionelle anisotropi ved anvendelse af Tract Based Spatial Statistics; for en fuldstændig beskrivelse af disse metoder, se Smith et al. (2006). Kort fortalt blev billeder ikke-lineært registreret til et målbillede (MNI152), middelbilledet blev derefter oprettet fra alle datasæt, og dette billede blev efterfølgende udtyndet for at repræsentere alle områder, der var fælles for alle forsøgspersoner. Hvert individs højeste fraktionelle anisotropi-værdier blev derefter projiceret på skelettet ved at søge i hvidt stof vinkelret på hvert punkt på skelettet af hvidt stof. En voxel-vis statistisk analyse af hele hjernen blev derefter udført mellem grupperne (14PNIr og 14 raske kontroller), og billederne blev helhjernekorrigeret ved P50.05. Derudover blev der udført en interesseområdeanalyse i hvidt stof skrifter støder op til den kontralaterale S1, thalamus og bilateral anterior og posterior insula. Disse regioner blev valgt, da de tidligere har været impliceret i aspekter af somatosensation, og fordi de svarer til regioner, der blev identificeret i fMRI- og kortikal tykkelsesanalyse (CTA) gruppeanalyser. Områder af interesse blev tegnet på skelettet af hvidt stof som følger: (i) Det kontralaterale S1-område af interesse stammer medialt ved krydset mellem skeletet af hvidt stof i corona-radiata og skeletsektionen, der føder ind i den post-centrale gyrus; afsluttes i slutningen af kanalen inden for en given skive.
I z-retningen strakte området af interesse sig fra z=49 til 57; hvide substanser, der forsyner håndregionen. (ii) Den kontralaterale thalamus-region af interesse var begrænset til hvide stof-spor omkring de posteriore og mediale thalamuskerner (kerner involveret i somatosensorisk funktion), der strækker sig fra z = �1 til 4. (iii) Insulære områder af interesse blev tegnet bilateralt inden for hvidt stof støder op til den forreste og bageste insula baseret på kriterier tidligere offentliggjort af vores laboratorium (Taylor et al., 2008b). Området af interesse strakte sig fra z = 2 til 8. Fraktionelle anisotropiværdier blev ekstraheret fra hver af disse områder af interesse, og en multivariat variansanalyse (MANOVA) blev udført ved hjælp af Statistical Package for the Social Sciences v13.0 (SPSS Inc, Chicago), som inkluderede fraktioneret anisotropiværdier for alle seks områder af interesse.
Resultater
Tabel 1 giver demografiske detaljer for undersøgelsesdeltagere. Alle 14 patienter pådrog sig en fuldstændig gennemskæring af højre median og/eller ulnar nerve efterfulgt af mikrokirurgisk reparation mindst 1.5 år før studieindskrivning. Tiden fra operation til test varierede fra 1.5 til 8 år med et gennemsnit (?SD) på 4.8 ? 3 år. Patienter og kontroller gjorde det ikke (34 - 10 år begge grupper; t = 0.04; P = 0.97).
Psykofysik
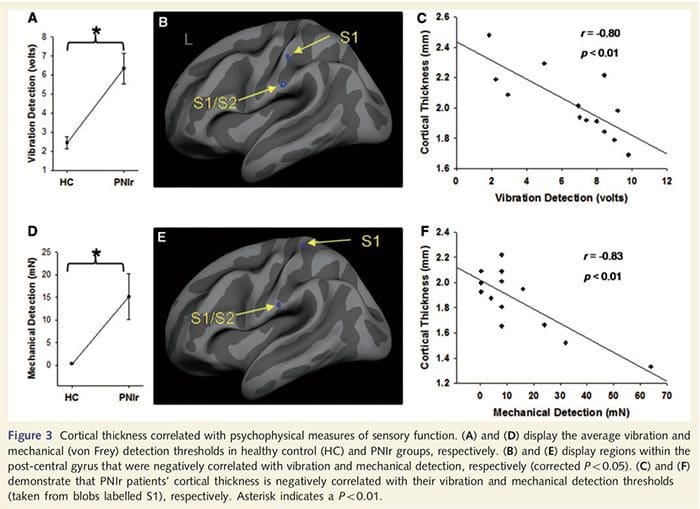
Vibrationstærskler blev beregnet ud fra alle tre målinger, eftersom variansanalyse af en-vejs gentagne målinger (ANOVA) indikerede ingen signifikante forskelle mellem de tre forsøg [F (25, 1)=0.227, P=0.64]. Vibrations- og mekaniske detektionstærskler var signifikant svækket hos PNIr-patienter sammenlignet med raske kontroller (vibration: t = 4.77, P50.001, Fig. 3A; mekanisk: t=3.10, P=0.005, Fig. 3D).
Test af nerveledning
Amplitude- og latensmålinger opnået fra hver patients kontralesionale nerver blev klassificeret som normale af en erfaren neurolog på Toronto Western Hospital EMG Clinic. Ni af de 14 patienter gennemførte nerveledningstest. Tabel 2 viser den gennemsnitlige stigning/reduktion latens og amplitudedata for sensorisk nerveledning fra håndleddet til abductor pollicis brevis (median) eller abductor digiti minimi (ulnar) muskler og for sensorisk ledning fra håndleddet til D2 (median) og D5 ( ulnar) sammenlignet med hver patient uskadet kontralesional nerve. Ud af ni havde syv patienter transektioner, der omfattede medianusnerven. Ud af disse syv havde en patient ingen påviselig respons under motorisk testning, og en anden patient havde ingen påviselig respons under sensorisk test.
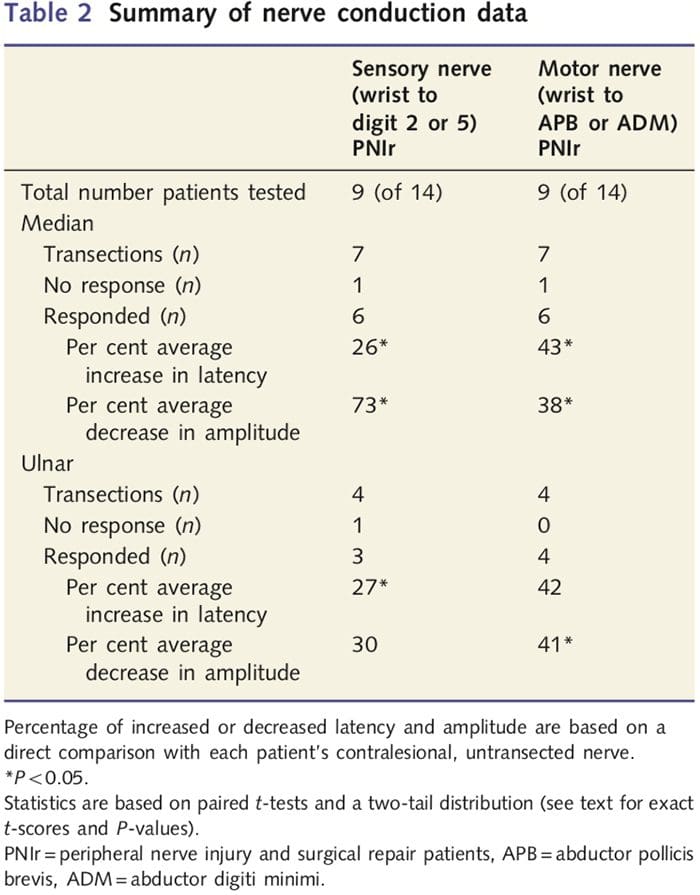 Hos de seks patienter med påviselige responser blev motorledningslatenserne øget med 43 % (t=6.2; P=0.002), og amplituderne blev reduceret med 38 % (t=�2.6; P=0.045), når hver patients transekserede nerve blev sammenlignet med deres ikke-skadede side. Sensorisk ledning i mediannerver afslørede også en 26 % stigning i latens (t=3.9; P=0.011) og et 73 % fald i amplitude (t=�8.0; P=0.000) sammenlignet med normale kontralesionale nerver. Hos de fire patienter med ulnar nervetransektioner havde en patient ingen påviselig respons under sensorisk nervetest. Hos de patienter med respons var ulnar nervemotoriske latenser ikke signifikant forhøjede (t = 2.8; P = 0.070); amplituderne var imidlertid signifikante
Hos de seks patienter med påviselige responser blev motorledningslatenserne øget med 43 % (t=6.2; P=0.002), og amplituderne blev reduceret med 38 % (t=�2.6; P=0.045), når hver patients transekserede nerve blev sammenlignet med deres ikke-skadede side. Sensorisk ledning i mediannerver afslørede også en 26 % stigning i latens (t=3.9; P=0.011) og et 73 % fald i amplitude (t=�8.0; P=0.000) sammenlignet med normale kontralesionale nerver. Hos de fire patienter med ulnar nervetransektioner havde en patient ingen påviselig respons under sensorisk nervetest. Hos de patienter med respons var ulnar nervemotoriske latenser ikke signifikant forhøjede (t = 2.8; P = 0.070); amplituderne var imidlertid signifikante
faldet med 41 % (t = 5.9; P = 0.010). Sensorisk test af ulnarnerven viste en 27 % stigning i latens (t = 4.3; P = 0.049), men ingen signifikant stigning i amplitude (t = 3.5; P = 0.072).
Funktionel plasticitet i den primære somatosensoriske cortex
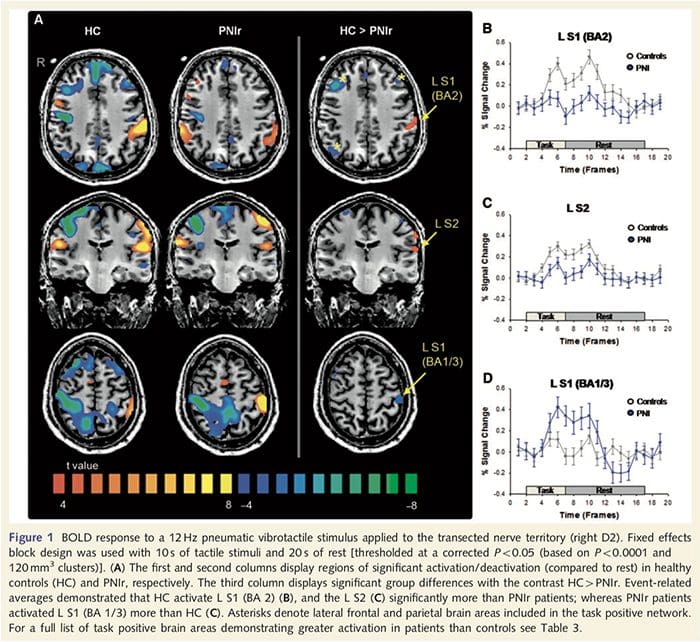
Funktionelle MR-kort blev beregnet ud fra de 11 PNIr-patienter med højre median nervetransektioner (patienter med ulnar nervetransektioner blev udelukket fra denne analyse) og 11 alders- og kønsmatchede raske kontroller. Fra fig. 1A er det klart, at PNIr-patienter har signifikant mindre aktivering, sammenlignet med raske kontroller, i en region af S1 svarende til Brodmann område 2 (BA2) (Talairach og Tournoux, 1988) og S2 (se tabel 3 for detaljer). . De gennemsnitlige hændelsesrelaterede responser fra disse områder af interesse fremhæver det svækkede BOLD-respons i patienternes venstre BA2 og venstre S2 (henholdsvis fig. 1B og C). Mærkeligt nok aktiverede vibrotaktil stimulering hos patienterne en mere overlegen del af den post-centrale gyrus (sandsynligvis BA1/3) (Talairach og Tournoux, 1988) (fig. 1A og tabel 3). Et hændelsesrelateret gennemsnit (fig. 1D) viser, at raske kontroller havde minimal aktivering i denne region. Endvidere havde patienter signifikant mere aktivering i hjerneregioner, der kollektivt er kendt som det opgavepositive netværk (stjerner i fig. 1). Se tabel 3 for den fulde liste over aktivitetspositive hjerneområder aktiverede. Dette netværk omfatter laterale præfrontale, laterale parietale, præmotoriske og inferior temporale cortex (tabel 3): hjerneområder, der aktiveres under udførelsen af en opmærksomhedskrævende opgave og undertrykkes eller inaktive under hvile eller opgaver, der ikke er kognitivt eller opmærksomhedsmæssigt udfordrende (Fox et al. al., 2005; DeLuca et al., 2006; Seminowicz og Davis 2007).
Reduceret grå substans i den primære somatosensoriske cortex korrelerer med sensorisk restitution
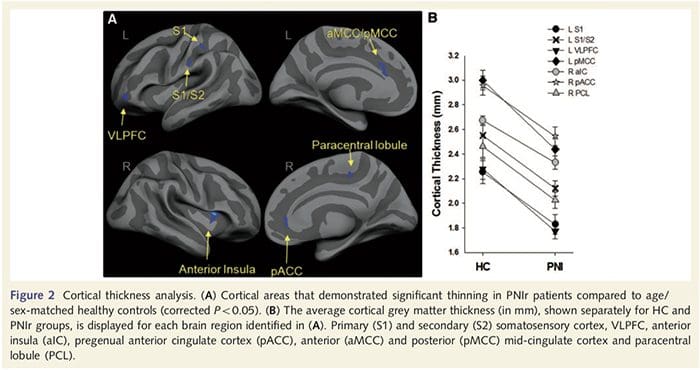
Kortikal tykkelsesanalyse hos alle 14 patienter og 14 raske kontroller, der matchede alder og køn, afslørede adskillige loci af signifikant kortikal udtynding i PNIr-gruppen (fig. 2 og tabel 4). Specifikt havde patienterne en reduktion på 13 %–22 % i kortikal tykkelse i venstre (kontralesional) S1, S2, prægenual anterior cingulate gyrus, ventrolateral præfrontal cortex og højre anterior insula, anterior/posterior mid cingulate gyrus og paracentral lobule. Interessant nok falder placeringerne af grå substans udtynding i den post-centrale gyrus sammen med regionerne med reduceret BOLD efter vibrotaktil stimulering (tabel 4). Da vi havde forudgående kendskab til patienternes sensoriske deficit og restitutionstid (dvs. tid siden mikrokirurgisk reparation), spurgte vi derefter, om patienternes kortikale tykkelse i den post-centrale gyrus korrelerede med deres sensoriske mekaniske og vibrationsdetektionstærskler eller med deres restitutionstid. Disse analyser afslørede en negativ korrelation mellem kortikal tykkelse og vibrationsdetektionstærskler i et område, der omfatter BA1/2 og S2 (P50.001, r=?0.80 og ?0.91, for henholdsvis BA1/2 og S2; fig. 3 og tabel 5 ). Derudover var mekaniske detektionstærskler også negativt korreleret med kortikal tykkelse i en lidt mere overlegen BA2-region og den samme S2-region (P50.001, r = ?0.83 og ?0.85, for henholdsvis BA2 og S2; fig. 3 og tabel 5). Vi identificerede dog ikke et signifikant forhold mellem restitutionstid og kortikal tykkelse. Derfor var kortikal udtynding i den post-centrale gyrus forbundet med mere alvorlige sensoriske underskud. Vi identificerede dog ikke et signifikant forhold mellem restitutionstid og kortikal tykkelse. Igen var der en overensstemmelse mellem den kortikale udtynding i områder, der var negativt korreleret med vibrationsstimuli, og de regioner, der viste gruppe-fMRI- og CTA-abnormiteter.
Hvidstof-abnormiteter efter nervetransektion
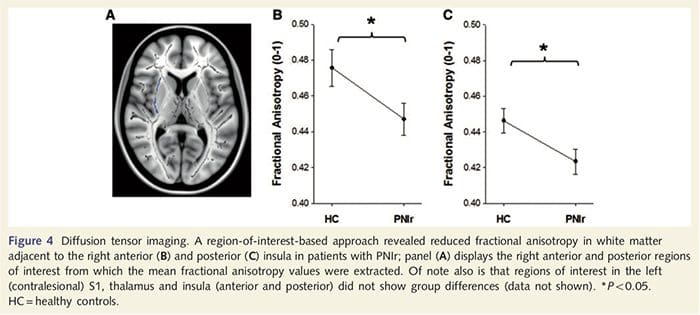
For at vurdere hvidt stofs integritet brugte vi en region af interesse til at undersøge forskelle i hvide stofgrupper baseret på a priori hypoteser. Områder af interesse var begrænset til områder med hvidt stof, der omgiver og føder ind i den kontralæsionelle S1 og thalamus. Derudover tegnede vi også områder af interesse for hvidt stof, der støder op til venstre og højre, anterior og posterior insula. Insulaen blev valgt, da den er impliceret i somatosensorisk bearbejdning, og fordi vi identificerede reduceret gråt stof i den højre forreste ø med CTA. Denne område af interesse tilgang afslørede, at patienter havde signifikant reducerede hvide stof fraktioneret anisotropi værdier (MANOVA inklusive alle seks områder af interesse) støder op til højre anterior [F (1, 26) = 4.39, P = 0.046; fig. 4A] og posterior insula [F (1, 26) = 5.55, P = 0.026; Fig. 4B], men der var ingen gruppeforskelle i det hvide stof, der støder op til venstre insula (venstre forreste insula: P = 0.51; venstre posterior insula: P=0.26), thalamus (P=0.46) eller S1 (P=0.46) ).
 Diskussion
Diskussion
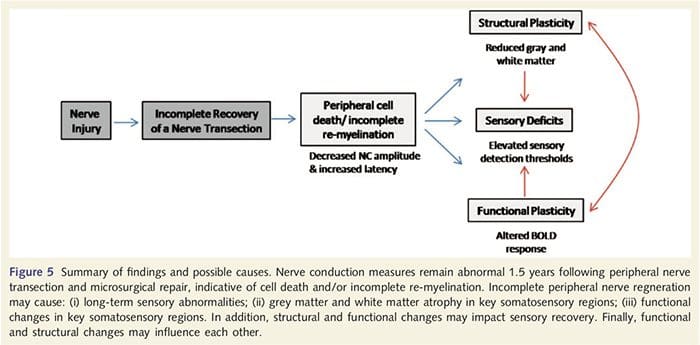
Her har vi for første gang påvist, at der er funktionel plasticitet og strukturelle abnormiteter i både grå og hvid substans i flere kortikale områder efter perifer nervetransektion i øvre lemmer og kirurgisk reparation. Denne plasticitet kan opstå som følge af ufuldstændig perifer nerveregeneration (perifer celledød og/eller ufuldstændig re-myelinisering), da nerveledningsforanstaltninger hos disse patienter viste alvorlige abnormiteter. Derudover viser vores data, at nedsatte vibrotaktile-fremkaldte fMRI-responser i den post-centrale gyrus svarer til udtynding af grå stof i patientgruppen. Disse resultater tyder på, at reducerede BOLD-responser kan lettes af en reduktion i kortikalt gråt stof og/eller et fald i det afferente input til den post-centrale gyrus. Derudover korrelerede kortikal tykkelse inden for de samme dele af den post-centrale gyrus negativt med adfærdsmæssige mål for somatosensorisk funktion. Det vil sige, at øgede somatosensoriske underskud var korreleret med tyndere cortex; som begge kan være relateret til afferente input. Samlet tyder vores data på, at ufuldstændig perifer nerveregenerering bidrager til somatosensoriske svækkelser, kortikal grå substans atrofi og reduceret fMRI-aktivering (se fig. 5 for en oversigt over disse fund).
Det er velkendt, at kortikal plasticitet efter perifer nervetransektion og kirurgisk reparation kan forekomme i hele CNS hos ikke-menneskelige primater (Kaas, 1991). Denne plasticitet menes at skyldes afsløringen af tidligere tavse synapser eller aksonal spiring ind i afafferent territorium (Wall et al., 1986; Florence og Kaas, 1995). I primatmodellen, 1 år efter nervetransektion og kirurgisk reparation, er den denerverede cortex karakteriseret ved ufuldstændige og uordnede repræsentationer af de regenererede og tilstødende (intakte) nerver. Denne plettede repræsentation tilskrives ufuldstændig perifer regenerering, hvilket resulterer i en delvis genopretning af det denerverede kortikale rum (Kaas, 1991). For at vurdere omfanget af perifer regenerering i vores patientpopulation udførte vi sensoriske og motoriske nerveledningsundersøgelser på tværs af det gennemskårne område. Vores nerveledningsresultater viser, at PNIr-patienter har signifikant nedsat amplitude og øget latens i både sensoriske og motoriske nerver sammenlignet med deres egen utranssekerede side. Nedsat amplitude kombineret med øget latens er tegn på tab af perifert fiber (dvs. celledød) og/eller unormal eller ufuldstændig re-myelinisering efter transektion (Kimura, 1984). Derudover er det veletableret, at mellem 20% og 50% af dorsale rodganglieneuroner dør efter nervetransektion (Liss et al., 1996). Afferent celledød og ufuldstændig regenerering kan således resultere i nedsat afferent input til cortex, hvilket kan forklare igangværende sensoriske underskud og nedsat BOLD-respons i BA2 og S2. Desuden kunne dette formindskede afferente input også forklare den kortikale udtynding, vi observerede i de samme områder af cortex. Sensorisk deprivation har vist sig at forårsage transneuronal degeneration i flere regioner af CNS, herunder det dorsale horn efter iskiasnerveafsnit (Knyihar-Csillik et al., 1989), og kan involvere anden- og tredjeordens neuroner (Powell og Erulkar, 1962). Transneuronal degeneration er karakteriseret ved cellekrympning og menes at være relateret til nedsat eller ikke-eksisterende afferent input (Knyihar-Csillik et al., 1989). Således kan kortikalt gråstoftab (eller atrofi) også være direkte relateret til nedsat afferent input.
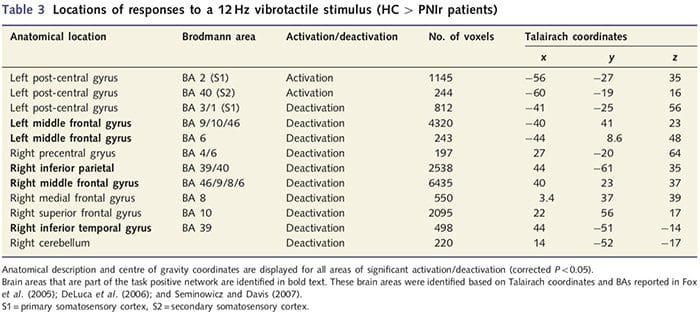
 Vi påviste også øget aktivering i den post-centrale gyrus i en region svarende til BA1/3 (Talairach og Tournoux, 1988). Elektrofysiologiske, anatomiske sporings- og neuroimaging undersøgelser har fastslået, at for størstedelen af kutane mekanoreceptive afferenter er de første kortikale destinationer BA1 og BA3b. Disse cytoarkitektoniske hjerneområder har hver et somatotopisk kropskort med små modtagelige felter. Derudover reagerer disse områder på mange træk ved taktil information, såsom tekstur og ruhed, hastighed og krumning af stimuli (Bodegard et al., 2001). fMRI-undersøgelser har vist, at aktivitet i den somatosensoriske cortex påvirkes af opmærksomhed, således at fMRI-responser på taktile stimuli i S1 øges, når forsøgspersoner behandler en taktil stimulus, men dæmpes, når forsøgspersoner er distraheret (Arthurs et al., 2004; Porro et al., 2004). Desuden aktiverede vores patienter et netværk af hjerneområder kendt som det opgavepositive netværk (DeLuca et al., 2006) mere end sunde kontroller. Disse hjerneområder aktiveres under opmærksomhedskrævende processer (Fox et al., 2005; Seminowicz og Davis, 2007). Tilsammen indebærer disse resultater, at patienter skal være mere opmærksomme på stimulus end kontroller på grund af deres svækkede sensoriske input. Denne øgede opmærksomhed kan også forklare den øgede aktivering i BA1/3b. Selvfølgelig kan den øgede aktivering i BA1/3b også afspejle plasticitet, der ikke er relateret til opmærksomhedsbelastning.
Vi påviste også øget aktivering i den post-centrale gyrus i en region svarende til BA1/3 (Talairach og Tournoux, 1988). Elektrofysiologiske, anatomiske sporings- og neuroimaging undersøgelser har fastslået, at for størstedelen af kutane mekanoreceptive afferenter er de første kortikale destinationer BA1 og BA3b. Disse cytoarkitektoniske hjerneområder har hver et somatotopisk kropskort med små modtagelige felter. Derudover reagerer disse områder på mange træk ved taktil information, såsom tekstur og ruhed, hastighed og krumning af stimuli (Bodegard et al., 2001). fMRI-undersøgelser har vist, at aktivitet i den somatosensoriske cortex påvirkes af opmærksomhed, således at fMRI-responser på taktile stimuli i S1 øges, når forsøgspersoner behandler en taktil stimulus, men dæmpes, når forsøgspersoner er distraheret (Arthurs et al., 2004; Porro et al., 2004). Desuden aktiverede vores patienter et netværk af hjerneområder kendt som det opgavepositive netværk (DeLuca et al., 2006) mere end sunde kontroller. Disse hjerneområder aktiveres under opmærksomhedskrævende processer (Fox et al., 2005; Seminowicz og Davis, 2007). Tilsammen indebærer disse resultater, at patienter skal være mere opmærksomme på stimulus end kontroller på grund af deres svækkede sensoriske input. Denne øgede opmærksomhed kan også forklare den øgede aktivering i BA1/3b. Selvfølgelig kan den øgede aktivering i BA1/3b også afspejle plasticitet, der ikke er relateret til opmærksomhedsbelastning.
 BA2 og S2 modtager begge projektioner fra BA1/3b og også fra adskilte dele af det ventroposteriore thalamiske kompleks (Pons et al., 1985; Friedman og Murray, 1986). Begge disse hjernen områder har store, ofte flercifrede (BA2) eller bilaterale (S2) modtagelige felter (Pons et al., 1985; Iwamura et al., 2002). Baseret på anatomiske projektioner og neuronale responsegenskaber er hierarkisk bearbejdning af taktil information blevet demonstreret fra BA1/3b til BA 2 (Kaas et al., 2002). Derudover tyder elektrofysiologiske undersøgelser i makaker (Pons et al., 1987) og magnetoencefalografi-data erhvervet hos mennesker, at seriel behandling af taktile input forekommer fra S1 til S2 hos højere primater (Frot og Mauguiere 1999; Disbrow et al. ., 2001). Adskillige undersøgelser har vist, at BA2 fortrinsvis aktiveres af form og krumning (Bodegard et al., 2001), mens S2 kan være involveret i taktil læring (Ridley og Ettlinger 1976; Murray og Mishkin, 1984), hvilket understøtter forestillingen om, at disse hjerneområder er involveret i højere ordens somatosensorisk behandling. Vores psykofysiske vurdering viste, at patienter var signifikant svækket ved påvisning af simple taktile stimuli og i Shape Texture Identification-testen 1.5 år efter operationen (Taylor et al., 2008a). Denne sidstnævnte test vurderer en patients evne til at genkende en genstands karakteristika, mens den aktivt udforsker en form eller tekstur, hvilket kræver integration af sensorisk information på tværs af kroppens områder (Rosen og Lundborg, 1998). Samlet set er en fortolkning af vores data, at PNIr-patienter tager mere hensyn til den vibrotaktile stimulus, hvilket fører til øget aktivering af det opgavepositive netværk og BA1/3. Hos disse patienter antyder vores data imidlertid, at højere ordens behandlingsområder, såsom BA2 og S2, ikke modtog taktil information, hvilket igen kan resultere i kortikal udtynding og reducerede BOLD-responser.
BA2 og S2 modtager begge projektioner fra BA1/3b og også fra adskilte dele af det ventroposteriore thalamiske kompleks (Pons et al., 1985; Friedman og Murray, 1986). Begge disse hjernen områder har store, ofte flercifrede (BA2) eller bilaterale (S2) modtagelige felter (Pons et al., 1985; Iwamura et al., 2002). Baseret på anatomiske projektioner og neuronale responsegenskaber er hierarkisk bearbejdning af taktil information blevet demonstreret fra BA1/3b til BA 2 (Kaas et al., 2002). Derudover tyder elektrofysiologiske undersøgelser i makaker (Pons et al., 1987) og magnetoencefalografi-data erhvervet hos mennesker, at seriel behandling af taktile input forekommer fra S1 til S2 hos højere primater (Frot og Mauguiere 1999; Disbrow et al. ., 2001). Adskillige undersøgelser har vist, at BA2 fortrinsvis aktiveres af form og krumning (Bodegard et al., 2001), mens S2 kan være involveret i taktil læring (Ridley og Ettlinger 1976; Murray og Mishkin, 1984), hvilket understøtter forestillingen om, at disse hjerneområder er involveret i højere ordens somatosensorisk behandling. Vores psykofysiske vurdering viste, at patienter var signifikant svækket ved påvisning af simple taktile stimuli og i Shape Texture Identification-testen 1.5 år efter operationen (Taylor et al., 2008a). Denne sidstnævnte test vurderer en patients evne til at genkende en genstands karakteristika, mens den aktivt udforsker en form eller tekstur, hvilket kræver integration af sensorisk information på tværs af kroppens områder (Rosen og Lundborg, 1998). Samlet set er en fortolkning af vores data, at PNIr-patienter tager mere hensyn til den vibrotaktile stimulus, hvilket fører til øget aktivering af det opgavepositive netværk og BA1/3. Hos disse patienter antyder vores data imidlertid, at højere ordens behandlingsområder, såsom BA2 og S2, ikke modtog taktil information, hvilket igen kan resultere i kortikal udtynding og reducerede BOLD-responser.
Insulaen menes at spille en rolle i at integrere multimodal information, der er vigtig for sansemotoriske, følelsesmæssige, allostatiske/homeostatiske og kognitive funktioner (Devinsky et al., 1995; Critchley, 2004; Craig, 2008) og er blevet udpeget som en limbisk sensorisk cortex (Craig) , 2008). Adskillige undersøgelser har rapporteret insulær aktivering som reaktion på taktil stimulering (Gelnar et al., 1998;
Downar et al., 2002) og anatomiske sporingsundersøgelser i primater har vist, at insulaen er gensidigt forbundet med frontale, parietale og tindingelapper (Augustine, 1996). Hos vores patienter var den højre forreste insula det eneste kortikale område, der viste signifikant kortikal udtynding i forbindelse med reducerede fraktioneret anisotropi-værdier i det tilstødende hvide stof, hvilket tyder på, at den kortikale udtynding inden for denne region er forbundet med et tab af fibre, der rager til eller fra denne struktur. Den højre forreste insula er blevet impliceret i interoception, da den er placeret til at integrere homøostatisk input fra kroppen med motiverende, følelsesmæssige og sociale forhold (Craig, 2008). Ydermere har Critchley et al. (2004) rapporterede en sammenhæng mellem interoceptive evner og det grå stofvolumen af den højre forreste insula. I betragtning af vores konstatering af, at patienterne har nedsat grå substans i den højre forreste insula, ville det være af interesse at vurdere interoceptive evner efter perifer nerveskade i en fremtidig undersøgelse.
Tilsammen har vi for første gang påvist, at funktionelle og strukturelle ændringer er til stede i den menneskelige hjernebark 1.5 år efter en fuldstændig gennemskæring af en perifer nerve i øvre ekstremiteter, som blev mikrokirurgisk repareret. Derudover indikerer nerveledningsmål ufuldstændig perifer regenerering hos disse patienter. Desuden viser vi, at kortikal tykkelse er relateret til psykofysiske mål for restitution, idet tyndere cortex i BA2 og S2 var forbundet med dårligere somatosensorisk funktion. Disse data tyder på, at genetableringen af normale funktionelle aktiveringskort er direkte forbundet med den vellykkede regenerering af perifere afferenter.
Keri S. Taylor,1,2 Dimitri J. Anastakis2,3,4 og Karen D. Davis1,2,3
1 afdeling for hjerne, billeddannelse og adfærd � Systems Neuroscience, Toronto Western Research Institute, University Health Network, Toronto, Canada M5T258
2 Institute of Medical Science, University of Toronto, Canada
3 Department of Surgery, University of Toronto, Canada
4 Clinical Studies Resource Centre, Toronto Western Research Institute, University Health Network, Toronto, Canada M5T2S8
Korrespondance til: Karen D. Davis, Ph.D.,
Division of Brain, Imaging and Behavior � Systems Neuroscience, Toronto Western Research Institute,
Toronto Western Hospital,
Universitetets sundhedsnetværk,
Værelse MP14-306, 399 Bathurst Street,
Toronto, Ontario,
Canada M5T 2S8
E-mail: kdavis@uhnres.utoronto.ca
Anerkendelser
Forfatterne takker Mr. Geoff Pope, Dr. Adrian Crawley, Mr. Eugene Hlasny og Mr. Keith Ta for ekspert teknisk assistance. Forfatterne vil gerne takke Dr. Peter Ashby og Mr. Freddy Paiz fra Toronto Western Hospital EMG Clinic for at udføre nerveledningstestene og for at give ekspertvurdering af resultaterne. Forfatterne takker også Drs. Dvali, Binhammer, Fialkov og Antonyshyn for samarbejdet med dette projekt. Dr. Davis er en Canada Research Chair i hjerne og adfærd (CIHR MOP 53304).
Finansiering
The Physicians� Services Incorporated og en fælles frøbevilling fra University of Toronto Center for the Study of Pain/AstraZeneca.
Supplerende materiale
Supplerende materiale er tilgængeligt på Brain online.
blank
Referencer:
Apkarian AV, Sosa Y, Sonty S, et al. Kroniske rygsmerter er forbundet med
nedsat præfrontal og thalamus grå substans tæthed. J Neurosci
2004; 24: 10410�5.
Arthurs OJ, Johansen-Berg H, Matthews PM, Boniface SJ. Opmærksomhed
modulerer differentielt koblingen af fMRI BOLD og fremkaldt
potentielle signalamplituder i den menneskelige somatosensoriske cortex 7.
Exp Brain Res 2004; 157: 269�74.
Augustine JR. Kredsløb og funktionelle aspekter af ølappen
hos primater inklusive mennesker. Brain Res Brain Res Rev 1996; 22:
229�44.
Beaulieu C. Grundlaget for anisotrop vanddiffusion i nervesystemet
system – en teknisk gennemgang. NMR Biomed 2002; 15:435�55.
Bodegard A, Geyer S, Grefkes C, Zilles K, Roland PE. Hierarkisk
bearbejdning af taktil form i den menneskelige hjerne. Neuron 2001; 31:
317�28.
Craig AD. Interoception og følelser: Et neuroanatomisk perspektiv.
I: Lewis M, Haviland-Jones J, Barrett L, redaktører. Håndbog af
følelser. New York: Guildford Press; 2008. s. 272�87.
Critchley HD. Den menneskelige cortex reagerer på en interoceptiv udfordring.
Proc Natl Acad Sci USA 2004; 101: 6333�4.
Critchley HD, Wiens S, Rotshtein P, Ohman A, Dolan RJ. Neurale systemer
understøtter interoceptiv bevidsthed. Nat Neurosci 2004; 7: 189�95.
Dale AM, Fischl B, Sereno MI. Kortikal overfladebaseret analyse. I. Segmentering
og overfladerekonstruktion. Neuroimage 1999; 9: 179�94.
Davis KD, Pope G, Chen J, Kwan CL, Crawley AP, Diamant NE. Kortikal
udtynding i IBS: implikationer for homeostatika, opmærksomhed og smerte
forarbejdning. Neurology 2008; 70: 153�4.
DeLuca M, Beckmann CF, De SN, Matthews PM, Smith SM. fMRI hviler
statsnetværk definerer forskellige former for interaktioner på lang afstand
i den menneskelige hjerne. Neuroimage 2006; 29: 1359�67.
Devinsky O, Morrell MJ, Vogt BA. Bidrag af anterior cingulate
cortex til adfærd. Brain 1995; 118 (Pt 1): 279�306.
Disbrow E, Roberts T, Poeppel D, Krubitzer L. Beviser for interhemisfærisk
behandling af input fra hænderne i menneskelig S2
og PV. J Neurophysiol 2001; 85: 2236�44.
Downar J, Crawley AP, Mikulis DJ, Davis KD. Et kortikalt netværk følsomt
at stimulere fremtræden i en neutral adfærdsmæssig kontekst på tværs af flere
sensoriske modaliteter. J Neurophysiology 2002; 87: 615�20.
Draganski B, Moser T, Lummel N, et al. Fald af thalamisk grå
sag efter amputation af lemmer. Neuroimage 2006; 31: 951�7.
Fischl B, Dale AM. Måling af tykkelsen af den menneskelige hjernebark
fra magnetiske resonansbilleder. Proc Natl Acad Sci USA 2000; 97:
11050�5.
Fischl B, Sereno MI, Dale AM. Kortikal overfladebaseret analyse. II:
Inflation, udfladning og et overfladebaseret koordinatsystem.
Neuroimage 1999a; 9: 195�207.
Fischl B, Sereno MI, Tootell RB, Dale AM. Mellemfag i høj opløsning
gennemsnit og et koordinatsystem for den kortikale overflade. Hum hjerne
Mapp 1999b; 8: 272�84.
Florence SL, Kaas JH. Storstilet omorganisering på flere niveauer af
somatosensorisk vej følger terapeutisk amputation af hånden
hos aber. J Neurosci 1995; 15: 8083�95.
Fox MD, Snyder AZ, Vincent JL, Corbetta M, Van E, Raichle ME. Det
menneskets hjerne er iboende organiseret i dynamiske, anti-relaterede
funktionelle netværk. Proc Natl Acad Sci USA 2005; 102: 9673�9678.
Friedman DP, Murray EA. Thalamisk tilslutning af den anden
somatosensoriske område og tilstødende somatosensoriske felter af
lateral sulcus af makaken. J Comp Neurol 1986; 252: 348�73.
Frot M, Mauguiere F. Timing og rumlig fordeling af somatosensorisk
svar registreret i den øvre bred af den sylviske fissur (SII-området) i
mennesker. Cereb Cortex 1999; 9: 854�63.
Geha PY, Baliki MN, Harden RN, Bauer WR, Parrish TB, Apkarian AV.
Hjernen i kronisk CRPS smerte: unormal grå-hvid substans
interaktioner i følelsesmæssige og autonome regioner. Neuron 2008; 60:
570�81.
Gelnar PA, Krauss BR, Szeverenyi NM, Apkarian AV. Fingerspids repræsentation
i den menneskelige somatosensoriske cortex: en fMRI-undersøgelse.
Neuroimage 1998; 7: 261�83.
Hickmott PW, Steen PA. Store ændringer i dendritiske struktur
under reorganisering af voksen somatosensorisk cortex. Nat Neurosci
2005; 8: 140�42.
Iwamura Y, Tanaka M, Iriki A, Taoka M, Toda T. Behandling af
taktile og kinæstetiske signaler fra bilaterale sider af kroppen i
postcentral gyrus af vågne aber. Behav Brain Res 2002; 135:
185�90.
Jaquet JB, Luijsterburg AJ, Kalmijn S, Kuypers PD, Hofman A, Hovius SE.
Median, ulnar og kombineret median-ulnar nerveskader: funktionel
resultat og tilbagevenden til produktivitet. J Trauma 2001; 51: 687�92.
Jurkiewicz MT, Crawley AP, Verrier MC, Fehlings MG, Mikulis DJ.
Somatosensorisk kortikal atrofi efter rygmarvsskade: en voxelbaseret
morfometri undersøgelse. Neurology 2006; 66: 762�4.
Kaas JH. Plasticitet af sensoriske og motoriske kort hos voksne pattedyr. Annu
Rev Neurosci 1991; 14: 137�67.
Kaas JH, Jain N, Qi HX. Organiseringen af det somatosensoriske system i
primater. I: Nelson RJ, redaktør. Det somatosensoriske system.
Washington, DC: CRC Press; 2002. s. 1�25.
Kimura J. Elektrodiagnose ved sygdomme i nerve og muskler: principper
og praksis. Oxford: Oxford University Press; 2001.
Kimura J. Principper og faldgruber ved nerveledningsundersøgelser. Ann Neurol
1984; 16: 415�29.
Knyihar-Csillik E, Rakic P, Csillik B. Transneuronal degeneration i
primatens rygmarvs Rolando-substans fremkaldt af
aksotomi-induceret transganglionisk degenerativ atrofi af central
primære sensoriske terminaler. Cell Tissue Res 1989; 258: 515�25.
Liss AG, af Ekenstam FW, Wiberg M. Tab af neuroner i den dorsale rod
ganglier efter transektion af en perifer sensorisk nerve. En anatomisk
undersøgelse i aber. Scand J Plast Reconstr Surg Hand Surg 1996; 30:1�6.
Lotze M, Flor H, Grodd W, Larbig W, Birbaumer N. Fantombevægelser
og smerte. En fMRI-undersøgelse i amputerede overekstremiteter. Brain 2001;
124: 2268�77.
Manduch M, Bezuhly M, Anastakis DJ, Crawley AP, Mikulis DJ. Seriel
fMRI af adaptive ændringer i primær sensorimotorisk cortex efter
tommelfinger rekonstruktion. Neurology 2002; 59: 1278�81.
Maj A. Kroniske smerter kan ændre hjernens struktur. Smerte 2008;
137: 7�15.
McAllister RM, Gilbert SE, Calder JS, Smith PJ. Epidemiologien og
behandling af perifere nerveskader i øvre lemmer i moderne
øve sig. J Hand Surg (Br) 1996; 21:4�13.
Murray EA, Mishkin M. Relative bidrag fra SII og area5 til taktile
diskrimination hos aber 2. Behav Brain Res 1984; 11:67�83.
Napadow V, Kettner N, Ryan A, Kwong KK, Audette J, Hui KK.
Somatosensorisk kortikal plasticitet i karpaltunnelsyndrom - et tværsnit
fMRI evaluering. Neuroimage 2006; 31:520�30.
Oldfield RC. Vurderingen og analysen af handedness: Edinburgh
beholdning. Neuropsychologia 1971; 9: 97�113.
Pons TP, Garraghty PE, Cusick CG, Kaas JH. Den somatotopiske organisation
af område 2 hos makakaber 6. J Comp Neurol 1985; 241: 445�66.
Pons TP, Garraghty PE, Friedman DP, Mishkin M. Fysiologiske beviser
til seriel behandling i somatosensorisk cortex. Science 1987; 237:
417�20.
Porro CA, Lui F, Facchin P, Maieron M, Baraldi P. Percept-relateret aktivitet
i det menneskelige somatosensoriske system: funktionel magnetisk resonans
billeddiagnostiske undersøgelser. Magn Reson Imaging 2004; 22: 1539�48.
Powell TP, Erulkar S. Transneuronal celledegeneration i det auditive
relækerner hos katten. J Anat 1962; 96: 249�68.
Ridley RM, Ettlinger G. Nedsat taktil indlæring og fastholdelse efter
fjernelse af den anden somatiske sensoriske projektionsbark (SII) i
abe. Brain Res 1976; 109: 656�60.
Rosen B, Lundborg G. Et nyt taktilt gnosisinstrument i sensibilitet
afprøvning. J Hand Ther 1998; 11:251�7.
Seminowicz DA, Davis KD. Smerter forbedrer funktionel forbindelse
af et hjernenetværk fremkaldt af udførelsen af en kognitiv opgave.
J Neurophysiol 2007; 97: 3651�9.
Smith SM, Jenkinson M, Johansen-Berg H, et al. Tract-baseret rumlig
statistik: voxelvis analyse af multi-subjekt diffusionsdata.
Neuroimage 2006; 31: 1487�1505.
Talairach J, Tournoux P. Co-planar stereotaksisk atlas af den menneskelige hjerne.
New York: Thieme Medical Publishers Inc.; 1988.
Taylor KS, Anastakis DJ, Davis KD. Kroniske smerter efter perifer
nerveskade er forbundet med smertekatastrofer og neuroticisme.
Int Ass Stud Pain 2008a; 267.
Taylor KS, Davis KD. Stabilitet af taktil- og smerterelateret fMRI
hjerneaktiveringer: en undersøgelse af tærskelafhængige og
tærskeluafhængige metoder. Hum Brain Mapp 2009; 30:
1947�62.
Taylor KS, Seminowicz DA, Davis KD. To systemer af hviletilstand
forbindelse mellem insula og cingulate cortex. Hum hjerne
Kort 2008b;DOI:10.1002/hbm.20705.
Wall JT, Kaas JH, Sur M, Nelson RJ, Felleman DJ, Merzenich MM.
Funktionel reorganisering i somatosensoriske kortikale områder 3b og 1
af voksne aber efter median nerve reparation: muligt forhold til
sensorisk genopretning hos mennesker. J Neurosci 1986; 6: 218�33.
Luk harmonika
Oplysningerne heri om "At skære din nerve ændrer din hjerne | El Paso, TX." er ikke beregnet til at erstatte et en-til-en-forhold med en kvalificeret sundhedsperson eller autoriseret læge og er ikke medicinsk rådgivning. Vi opfordrer dig til at træffe sundhedsbeslutninger baseret på din forskning og partnerskab med en kvalificeret sundhedsperson.
Bloginformation og diskussioner om omfang
Vores informationsomfang er begrænset til kiropraktik, muskuloskeletal, fysisk medicin, wellness, bidragende ætiologisk viscerosomatiske forstyrrelser inden for kliniske præsentationer, tilhørende somatovisceral refleks klinisk dynamik, subluksationskomplekser, følsomme helbredsproblemer og/eller funktionel medicin artikler, emner og diskussioner.
Vi giver og præsenterer klinisk samarbejde med specialister fra forskellige discipliner. Hver specialist er styret af deres faglige omfang af praksis og deres licensjurisdiktion. Vi bruger funktionelle sundheds- og velværeprotokoller til at behandle og understøtte pleje af skader eller lidelser i bevægeapparatet.
Vores videoer, indlæg, emner, emner og indsigt dækker kliniske forhold, problemstillinger og emner, der relaterer til og direkte eller indirekte understøtter vores kliniske anvendelsesområde.*
Vores kontor har med rimelighed forsøgt at give støttende citater og har identificeret den eller de relevante forskningsundersøgelser, der understøtter vores indlæg. Vi leverer kopier af understøttende forskningsundersøgelser tilgængelige for tilsynsråd og offentligheden efter anmodning.
Vi forstår, at vi dækker forhold, der kræver yderligere forklaring på, hvordan det kan hjælpe med en bestemt plejeplan eller behandlingsprotokol. derfor er du velkommen til at spørge for yderligere at diskutere emnet ovenfor Dr. Alex Jimenez, DC, eller kontakte os på 915-850-0900.
Vi er her for at hjælpe dig og din familie.
Blessings
Dr. Alex Jimenez A.D. MSACP, RN*, CCST, Ifmcp*, CIFM*, ATN*
Email: coach@elpasofunctionalmedicine.com
Licenseret som Doctor of Chiropractic (DC) i Texas & New Mexico*
Texas DC-licensnummer TX5807, New Mexico DC Licensnr. NM-DC2182
Licenseret som registreret sygeplejerske (RN*) in Florida
Florida-licens RN-licens # RN9617241 (Kontrol nr. 3558029)
Kompakt status: Multi-State Licens: Bemyndiget til at praktisere i 40 stater*
Dr. Alex Jimenez DC, MSACP, RN*CIFM*, IFMCP*, ATN*, CCST
Mit digitale visitkort