Neurogen betændelse, eller NI, er den fysiologiske proces, hvor mediatorer udledes direkte fra de kutane nerver for at påbegynde en inflammatorisk reaktion. Dette resulterer i skabelsen af lokale inflammatoriske reaktioner, herunder erytem, hævelse, temperaturstigning, ømhed og smerte. Fine umyelinerede afferente somatiske C-fibre, som reagerer på mekaniske og kemiske stimulationer med lav intensitet, er i høj grad ansvarlige for frigivelsen af disse inflammatoriske mediatorer.
Når de stimuleres, frigiver disse nervebaner i de kutane nerver energiske neuropeptider, eller substans P og calcitoningenrelateret peptid (CGRP), hurtigt ind i mikromiljøet, hvilket udløser en række inflammatoriske reaktioner. Der er en betydelig forskel i immunogen betændelse, det er den allerførste beskyttende og reparerende reaktion fra immunsystemet, når et patogen kommer ind i kroppen, hvorimod neurogen inflammation involverer en direkte forbindelse mellem nervesystemet og de inflammatoriske reaktioner. Selvom neurogen inflammation og immunologisk inflammation kan eksistere samtidig, er de to ikke klinisk ude af skel. Formålet med artiklen nedenfor er at diskutere mekanismen bag neurogen inflammation og det perifere nervesystems rolle i værtsforsvar og immunopatologi.
Indhold
Neurogen inflammation � Det perifere nervesystems rolle i værtsforsvar og immunopatologi
Abstrakt
Det perifere nerve- og immunsystem anses traditionelt for at tjene separate funktioner. Denne linje bliver dog mere og mere sløret af ny indsigt i neurogen inflammation. Nociceptor-neuroner har mange af de samme molekylære genkendelsesveje for fare som immunceller, og som reaktion på fare kommunikerer det perifere nervesystem direkte med immunsystemet og danner en integreret beskyttelsesmekanisme. Det tætte innervationsnetværk af sensoriske og autonome fibre i perifert væv og høj hastighed af neural transduktion muliggør hurtig lokal og systemisk neurogen modulering af immunitet. Perifere neuroner ser også ud til at spille en væsentlig rolle i immundysfunktion ved autoimmune og allergiske sygdomme. Derfor kan forståelsen af den koordinerede interaktion af perifere neuroner med immunceller fremme terapeutiske tilgange til at øge værtsforsvaret og undertrykke immunopatologi.
Introduktion
For to tusind år siden definerede Celsus inflammation som involverer fire kardinaltegn � Dolor (smerte), Calor (varme), Rubor (rødme) og Tumor (hævelse), en observation, der indikerer, at aktivering af nervesystemet blev anerkendt som værende integreret i betændelse. Smerter er dog hovedsageligt blevet tænkt siden da, kun som et symptom og ikke en deltager i frembringelsen af betændelse. I dette perspektiv viser vi, at det perifere nervesystem spiller en direkte og aktiv rolle i at modulere medfødt og adaptiv immunitet, således at immun- og nervesystemet kan have en fælles integreret beskyttende funktion i værtsforsvaret og responsen på vævsskade, en indviklet interaktion, der også kan føre til patologi i allergiske og autoimmune sygdomme.
Organismers overlevelse er kritisk afhængig af evnen til at opbygge et forsvar mod potentiel skade fra vævsskade og infektion. Værtsforsvar involverer både undgåelsesadfærd for at fjerne kontakt med et farligt (skadeligt) miljø (en neural funktion) og aktiv neutralisering af patogener (en immunfunktion). Traditionelt er immunsystemets rolle i bekæmpelse af infektionsstoffer og reparation af vævsskader blevet betragtet som ret adskilt fra nervesystemets, som transducerer skadelige miljømæssige og interne signaler til elektrisk aktivitet for at producere fornemmelser og reflekser (fig. 1). Vi foreslår, at disse to systemer faktisk er komponenter i en samlet forsvarsmekanisme. Det somatosensoriske nervesystem er ideelt placeret til at opdage fare. For det første er alt væv, der er meget udsat for det ydre miljø, såsom epiteloverflader i huden, lungerne, urinvejene og fordøjelseskanalen, tæt innerveret af nociceptorer, højtærskel smerteproducerende sensoriske fibre. For det andet er transduktion af skadelige eksterne stimuli næsten øjeblikkelig, størrelsesordener hurtigere end mobiliseringen af det medfødte immunsystem, og kan derfor være den første responder i værtsforsvaret.
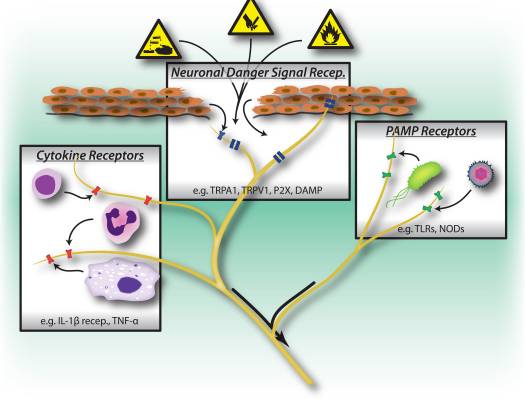
Figur 1: Skadelige stimuli, mikrobielle og inflammatoriske genkendelsesveje udløser aktivering af det perifere nervesystem. Sensoriske neuroner har adskillige metoder til at detektere tilstedeværelsen af skadelige/skadelige stimuli. 1) Faresignalreceptorer, herunder TRP-kanaler, P2X-kanaler og DAMP-receptorer (Danger Associated Molecular Model) genkender eksogene signaler fra miljøet (f.eks. varme, surhed, kemikalier) eller endogene faresignaler frigivet under traume/vævsskade (f.eks. ATP, urinsyre, hydroxynonenaler). 2) Mønstergenkendelsesreceptorer (PRR'er) såsom Toll-lignende receptorer (TLR'er) og Nod-lignende receptorer (NLR'er) genkender patogenassocierede molekylære mønstre (PAMP'er), som udskilles ved at invadere bakterier eller vira under infektion. 3) Cytokinreceptorer genkender faktorer udskilt af immunceller (f.eks. IL-1beta, TNF-alfa, NGF), som aktiverer kortkinaser og andre signalmekanismer for at øge membranexcitabilitet.
Udover ortodromiske input til rygmarven og hjernen fra periferien, kan aktionspotentialer i nociceptorneuroner også overføres antidromisk ved forgreningspunkter tilbage til periferien, axonrefleksen. Disse sammen med vedvarende lokale depolariseringer fører til en hurtig og lokal frigivelse af neurale mediatorer fra både perifere axoner og terminaler (fig. 2) 1. Klassiske eksperimenter af Goltz (i 1874) og af Bayliss (i 1901) viste, at elektrisk stimulerende dorsale rødder fremkalder vasodilatation af huden, hvilket førte til konceptet om en �neurogen inflammation�, uafhængig af den, der produceres af immunsystemet (fig. 3).
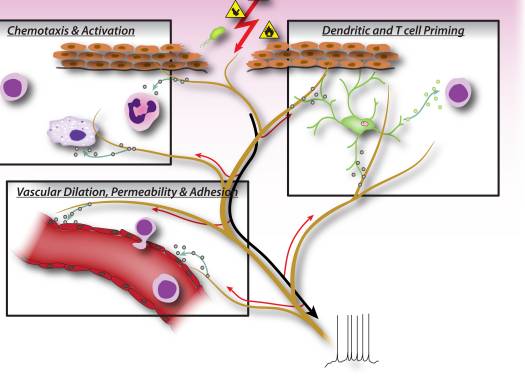
Figur 2: Neuronale faktorer frigivet fra nociceptor sensoriske neuroner driver direkte leukocytkemotaksi, vaskulær hæmodynamik og immunresponset. Når skadelige stimuli aktiverer afferente signaler i sensoriske nerver, genereres antidromiske axonreflekser, der inducerer frigivelsen af neuropeptider ved de perifere terminaler af neuronerne. Disse molekylære mediatorer har adskillige inflammatoriske virkninger: 1) Kemotaksi og aktivering af neutrofiler, makrofager og lymfocytter til skadestedet og degranulering af mastceller. 2) Signalering til vaskulære endotelceller for at øge blodgennemstrømningen, vaskulær lækage og ødem. Dette muliggør også lettere rekruttering af inflammatoriske leukocytter. 3) Priming af dendritiske celler for at drive efterfølgende T-hjælpercelledifferentiering til Th2- eller Th17-undertyper.

Figur 3: Tidslinje for fremskridt i forståelsen af de neurogene aspekter af inflammation fra Celsus til i dag.
Neurogen inflammation medieres af frigivelsen af neuropeptiderne calcitoningen-relateret peptid (CGRP) og substans P (SP) fra nociceptorer, som virker direkte på vaskulære endotelceller og glatte muskelceller 2�5. CGRP producerer vasodilatationseffekter 2, 3, hvorimod SP øger kapillær permeabilitet, hvilket fører til plasma ekstravasation og ødem 4, 5, hvilket bidrager til rubor, kalorie og tumor i Celsus. Nociceptorer frigiver dog mange yderligere neuropeptider (online database: www.neuropeptides.nl/), herunder Adrenomedullin, Neurokinin A og B, Vasoactive intestinal peptide (VIP), neuropeptid (NPY) og gastrin-releasing peptide (GRP), såvel som andre molekylære mediatorer såsom glutamat, nitrogenoxid (NO) og cytokiner såsom eotaxin 6.
Vi forstår nu, at mediatorerne frigivet fra sensoriske neuroner i periferien ikke kun virker på vaskulaturen, men også direkte tiltrækker og aktiverer medfødte immunceller (mastceller, dendritiske celler) og adaptive immunceller (T-lymfocytter) 7�12. I den akutte situation med vævsskader formoder vi, at neurogen inflammation er beskyttende, letter fysiologisk sårheling og immunforsvar mod patogener ved at aktivere og rekruttere immunceller. Imidlertid spiller sådanne neuro-immune kommunikationer sandsynligvis også store roller i patofysiologien af allergiske og autoimmune sygdomme ved at forstærke patologiske eller maladaptive immunresponser. I dyremodeller af reumatoid arthritis har Levine og kolleger for eksempel vist, at denervering af leddet fører til en slående svækkelse af inflammation, hvilket er afhængig af neural ekspression af substans P 13, 14. I nyere undersøgelser af allergisk luftvejsbetændelse, colitis og colitis. psoriasis, primære sensoriske neuroner spiller en central rolle i at initiere og forstærke aktiveringen af medfødt og adaptiv immunitet 15�17.
Vi foreslår derfor, at det perifere nervesystem ikke kun spiller en passiv rolle i værtsforsvaret (detektion af skadelige stimuli og initiering af undgåelsesadfærd), men også en aktiv rolle i samspil med immunsystemet i at modulere reaktionerne på og bekæmpe skadelige stimuli, en rolle, der kan undergraves for at bidrage til sygdom.
Fælles fare-genkendelsesveje i det perifere nervesystem og det medfødte immunsystem
Perifere sensoriske neuroner er tilpasset til at genkende fare for organismen i kraft af deres følsomhed over for intense mekaniske, termiske og irriterende kemiske stimuli (fig. 1). Transient receptor potential (TRP) ionkanaler er de mest undersøgte molekylære mediatorer af nociception, der udfører ikke-selektiv indtrængning af kationer efter aktivering af forskellige skadelige stimuli. TRPV1 aktiveres af høje temperaturer, lav pH og capsaicin, den vallinoidirriterende komponent i chilipeber 18. TRPA1 medierer påvisningen af reaktive kemikalier, herunder miljøirriterende stoffer såsom tåregas og industrielle isothiocyanater 19, men endnu vigtigere er det også aktiveret under væv skade ved endogene molekylære signaler, herunder 4-hydroxynonenal og prostaglandiner 20, 21.
Interessant nok deler sensoriske neuroner mange af de samme patogen- og faremolekylære genkendelsesreceptorveje som medfødte immunceller, hvilket gør dem i stand til også at detektere patogener (fig. 1). I immunsystemet detekteres mikrobielle patogener af germline-kodede mønstergenkendelsesreceptorer (PRR'er), som genkender bredt bevarede eksogene patogen-associerede molekylære mønstre (PAMP'er). De første PRR'er, der blev identificeret, var medlemmer af toll-like receptor (TLR)-familien, som binder til gær, bakterie-afledte cellevægskomponenter og viralt RNA 22. Efter PRR-aktivering aktiveres downstream-signalveje, som inducerer cytokinproduktion og -aktivering af adaptiv immunitet. Ud over TLR'er aktiveres medfødte immunceller under vævsskade af endogene afledte faresignaler, også kendt som skadesassocierede molekylære mønstre (DAMP'er) eller alarminer 23, 24. Disse faresignaler omfatter HMGB1, urinsyre og varmechokproteiner frigivet ved at dø celler under nekrose, aktivere immunceller under ikke-infektiøse inflammatoriske reaktioner.
PRR'er inklusive TLR'er 3, 4, 7 og 9 udtrykkes af nociceptorneuroner, og stimulering af TLR-ligander fører til induktion af indadgående strømme og sensibilisering af nociceptorer over for andre smertestimuli 25�27. Desuden fører aktivering af sensoriske neuroner af TLR7-liganden imiquimod til aktivering af en kløespecifik sensorisk vej 25. Disse resultater indikerer, at infektionsassocieret smerte og kløe delvist kan skyldes direkte aktivering af neuroner af patogen-afledte faktorer, som igen aktivere immunceller gennem perifer frigivelse af neuronale signalmolekyler.
En større DAMP/alarmin frigivet under cellulær skade er ATP, som genkendes af purinerge receptorer på både nociceptorneuroner og immunceller 28�30. Purinerge receptorer består af to familier: P2X-receptorer, ligand-gatede kationkanaler og P2Y-receptorer, G-proteinkoblede receptorer. I nociceptorneuroner sker genkendelse af ATP gennem P2X3, hvilket fører til hurtigt densensibiliserende kationstrømme og smerte 28, 30 (fig. 1), mens P2Y-receptorer bidrager til nociceptoraktivering ved sensibilisering af TRP og spændingsstyrede natriumkanaler. I makrofager fører ATP-binding til P2X7-receptorer til hyperpolarisering og nedstrøms aktivering af inflammasomet, et molekylært kompleks, der er vigtigt ved generering af IL-1beta og IL-18 29. Derfor er ATP et potent faresignal, der aktiverer både perifere neuroner og medfødte neuroner. immunitet under skade, og nogle beviser tyder endda på, at neuroner udtrykker dele af det inflammasommolekylære maskineri 31.
Bagsiden af faresignaler i nociceptorer er TRP-kanalernes rolle i immuncelleaktivering. TRPV2, en homolog af TRPV1 aktiveret af skadelig varme, udtrykkes i høje niveauer i medfødte immunceller 32. Genetisk ablation af TRPV2 førte til defekter i makrofagfagocytose og clearance af bakterielle infektioner 32. Mastceller udtrykker også TRPV-kanaler, som direkte kan mediere deres degranulering 33. Det mangler at blive afgjort, om endogene faresignaler aktiverer immunceller på samme måde som nociceptorer.
Et nøglemiddel til kommunikation mellem immunceller og nociceptorneuroner er gennem cytokiner. Ved aktivering af cytokinreceptorer aktiveres signaltransduktionsveje i sensoriske neuroner, hvilket fører til nedstrøms phosphorylering af membranproteiner inklusive TRP og spændingsstyrede kanaler (fig. 1). Den resulterende sensibilisering af nociceptorer betyder, at normalt uskadelige mekaniske stimuli og varmestimuli nu kan aktivere nociceptorer. Interleukin 1 beta og TNF-alfa er to vigtige cytokiner frigivet af medfødte immunceller under inflammation. IL-1beta og TNF-alfa registreres direkte af nociceptorer, som udtrykker de beslægtede receptorer, inducerer aktivering af p38 map kinaser, hvilket fører til øget membranexcitabilitet 34�36. Nervevækstfaktor (NGF) og prostaglandin E(2) er også vigtige inflammatoriske mediatorer frigivet fra immunceller, der virker direkte på perifere sensoriske neuroner for at forårsage sensibilisering. En vigtig effekt af nociceptor-sensibilisering af immunfaktorer er en øget frigivelse af neuropeptider ved perifere terminaler, som yderligere aktiverer immunceller og derved inducerer en positiv feedback-loop, der driver og letter inflammation.
Sensorisk nervesystemkontrol af medfødt og adaptiv immunitet
I tidlige faser af inflammation signalerer sensoriske neuroner til vævsresidente mastceller og dendritiske celler, som er medfødte immunceller, der er vigtige for at starte immunresponset (fig. 2). Anatomiske undersøgelser har vist en direkte apposition af terminaler med mastceller såvel som med dendritiske celler, og neuropeptiderne frigivet fra nociceptorer kan inducere degranulering eller cytokinproduktion i disse celler 7, 9, 37. Denne interaktion spiller en vigtig rolle i allergiske luftveje betændelse og dermatitis 10�12.
Under effektorfasen af inflammation skal immunceller finde vej til det specifikke skadested. Mange mediatorer frigivet fra sensoriske neuroner, neuropeptider, kemokiner og glutamat, er kemotaktiske for neutrofiler, eosinofiler, makrofager og T-celler og forbedrer endoteladhæsion, hvilket letter immuncellehosing 6, 38�41 (fig. 2). Desuden tyder nogle beviser på, at neuroner kan deltage direkte i effektorfasen, da neuropeptider selv kan have direkte antimikrobielle funktioner 42.
Neuronalt afledte signalmolekyler kan også styre typen af inflammation ved at bidrage til differentieringen eller specifikationen af forskellige typer adaptive immun-T-celler. Et antigen fagocyteres og behandles af medfødte immunceller, som derefter migrerer til den nærmeste lymfeknude og præsenterer det antigene peptid til nave T-celler. Afhængigt af typen af antigen, costimulerende molekyler på den medfødte immuncelle og kombinationerne af specifikke cytokiner, modnes nave T-celler til specifikke undertyper, der bedst tjener den inflammatoriske indsats for at fjerne den patogene stimulus. CD4 T-celler, eller T-hjælper (Th) celler, kan opdeles i fire hovedgrupper, Th1, Th2, Th17 og T regulatoriske celler (Treg). Th1-celler er hovedsageligt involveret i regulering af immunresponser på intracellulære mikroorganismer og organspecifikke autoimmune sygdomme; Th2 er kritiske for immunitet mod ekstracellulære patogener, såsom helminths, og er ansvarlige for allergiske inflammatoriske sygdomme; Th17-celler spiller en central rolle i beskyttelsen mod mikrobielle udfordringer, såsom ekstracellulære bakterier og svampe; Treg-celler er involveret i at opretholde selvtolerance og regulere immunresponser. Denne T-cellemodningsproces ser ud til at være stærkt påvirket af sensoriske neuronale mediatorer. Neuropeptider, såsom CGRP og VIP, kan påvirke dendritiske celler mod en Th2-type immunitet og reducere Th1-type immunitet ved at fremme produktionen af visse cytokiner og hæmme andre, samt ved at reducere eller øge dendritisk cellemigration til lokale lymfeknuder 8 , 10, 43. Sensoriske neuroner bidrager også betydeligt til allergisk (hovedsageligt Th2-drevet) inflammation 17. Ud over at regulere Th1- og Th2-celler kan andre neuropeptider, såsom SP og Hemokinin-1, drive den inflammatoriske reaktion mere mod Th17 eller Treg 44, 45, hvilket betyder, at neuroner også kan være involveret i at regulere inflammatorisk opløsning. I immunopatologier såsom colitis og psoriasis kan blokering af neuronale mediatorer som substans P dæmpe T-celler og immunmedieret skade 15-17 betydeligt, selvom antagonisering af én mediator i sig selv kun kan have en begrænset effekt på neurogen inflammation.
I betragtning af, at signalmolekyler frigivet fra perifere sensoriske nervefibre regulerer ikke kun små blodkar, men også kemotaksi, målsøgning, modning og aktivering af immunceller, bliver det klart, at neuro-immune interaktioner er meget mere indviklede end tidligere antaget (fig. . 2). Desuden er det ret tænkeligt, at det ikke er individuelle neurale mediatorer, men derimod specifikke kombinationer af signalmolekyler frigivet fra nociceptorer, der påvirker forskellige stadier og typer af immunresponser.
Autonomisk reflekskontrol af immunitet
En rolle for et kolinergt autonomt nervesystems �refleks� kredsløb i reguleringen af perifere immunresponser forekommer også fremtrædende 46. Vagusen er den primære parasympatiske nerve, der forbinder hjernestammen med viscerale organer. Arbejder af Kevin Tracey og andre peger på potente generaliserede antiinflammatoriske reaktioner ved septisk shock og endotoksæmi, udløst af en efferent vagusnerveaktivitet, der fører til undertrykkelse af perifere makrofager 47�49. Vagusen aktiverer perifere adrenerge cøliakiganglieneuroner, der innerverer milten, hvilket fører til nedstrøms frigivelse af acetylcholin, som binder til alfa-7 nikotinreceptorer på makrofager i milten og mave-tarmkanalen. Dette inducerer aktivering af JAK2/STAT3 SOCS3-signalvejen, som kraftigt undertrykker TNF-alfa-transskription 47. Den adrenerge cøliakiganglion kommunikerer også direkte med en undergruppe af acetylcholin-producerende hukommelses-T-celler, som undertrykker inflammatoriske makrofager 48.
Invariante naturlige dræber-T-celler (iNKT) er en specialiseret undergruppe af T-celler, der genkender mikrobielle lipider i sammenhæng med CD1d i stedet for peptidantigener. NKT-celler er en vigtig lymfocytpopulation involveret i bekæmpelse af infektiøse patogener og regulering af systemisk immunitet. NKT-celler opholder sig og transporteres hovedsageligt gennem vaskulaturen og sinusoiderne i milten og leveren. Sympatiske beta-adrenerge nerver i leveren signalerer direkte til at modulere NKT-celleaktivitet 50. Under en musemodel af slagtilfælde (MCAO), for eksempel, blev lever-NKT-cellemobiliteten synligt undertrykt, hvilket blev vendt af sympatisk denervering eller beta-adrenerge antagonister. Desuden førte denne immunsuppressive aktivitet af noradrenerge neuroner på NKT-celler til stigninger i systemisk infektion og lungeskade. Derfor kan efferente signaler fra autonome neuroner mediere en potent immunsuppression.

Dr. Alex Jimenez's Insight
Neurogen betændelse er en lokal inflammatorisk reaktion genereret af nervesystemet. Det menes at spille en grundlæggende rolle i patogenesen af en række sundhedsproblemer, herunder migræne, psoriasis, astma, fibromyalgi, eksem, rosacea, dystoni og multipel kemisk følsomhed. Selvom neurogen inflammation forbundet med det perifere nervesystem er blevet grundigt undersøgt, kræver begrebet neurogen inflammation i centralnervesystemet stadig yderligere forskning. Ifølge flere forskningsundersøgelser menes magnesiummangel dog at være hovedårsagen til neurogen inflammation. Den følgende artikel demonstrerer et overblik over mekanismerne bag neurogen inflammation i nervesystemet, som kan hjælpe sundhedspersonale med at bestemme den bedste behandlingstilgang til behandling af en række sundhedsproblemer forbundet med nervesystemet.
konklusioner
Hvad er de respektive specifikke roller for det somatosensoriske og det autonome nervesystem i reguleringen af inflammation og immunsystemet (fig. 4)? Aktivering af nociceptorer fører til lokale axonreflekser, som lokalt rekrutterer og aktiverer immunceller og derfor hovedsageligt er pro-inflammatorisk og rumligt begrænset. I modsætning hertil fører autonom stimulering til en systemisk immunsuppression ved at påvirke puljer af immunceller i lever og milt. De afferente signalmekanismer i periferien, der fører til udløsningen af det immunsuppressive vagale kolinerge reflekskredsløb, er dårligt forstået. Imidlertid er 80-90 % af vagale fibre primære afferente sensoriske fibre, og derfor kan signaler fra indvoldene, mange potentielt drevet af immunceller, føre til aktivering af interneuroner i hjernestammen og gennem dem til et output i efferente vagale fibre 46.
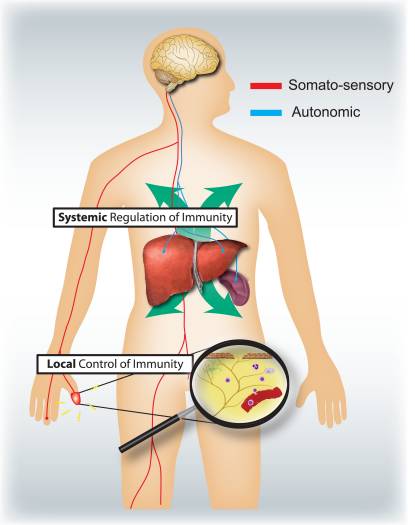
Figur 4: Sensoriske og autonome nervesystemer modulerer henholdsvis lokale og systemiske immunresponser. Nociceptorer, der innerverer epiteloverflader (f.eks. hud og lunger), inducerer lokaliserede inflammatoriske reaktioner, aktiverer mastceller og dendritiske celler. Ved allergisk luftvejsbetændelse, dermatitis og reumatoid arthritis spiller nociceptorneuroner en rolle i at drive inflammation. Derimod regulerer autonome kredsløb, der innerverer de viscerale organer (f.eks. milt og lever), systemiske immunresponser ved at blokere makrofag- og NKT-celleaktivering. Ved slagtilfælde og septisk endotoksæmi spiller disse neuroner en immunsuppressiv rolle.
Typisk er tidsforløbet og arten af inflammation, hvad enten det er under infektion, allergiske reaktioner eller autoimmune patologier, defineret af kategorierne af involverede immunceller. Det vil være vigtigt at vide, hvilke forskellige typer af immunceller, der reguleres af sensoriske og autonome signaler. En systematisk vurdering af, hvilke mediatorer der kan frigives fra nociceptorer og autonome neuroner og ekspressionen af receptorer for disse af forskellige medfødte og adaptive immunceller kan hjælpe med at løse dette spørgsmål.
Under evolutionen er der udviklet lignende faredetektionsmolekyler for både medfødt immunitet og nociception, selvom cellerne har helt forskellige udviklingslinjer. Mens PRR'er og skadelige ligand-gatede ionkanaler studeres separat af immunologer og neurobiologer, bliver linjen mellem disse to felter i stigende grad sløret. Under vævsskade og patogen infektion vil frigivelse af faresignaler sandsynligvis føre til en koordineret aktivering af både perifere neuroner og immunceller med kompleks tovejskommunikation og et integreret værtsforsvar. Den anatomiske placering af nociceptorer ved grænsefladen til miljøet, hastigheden af neural transduktion og deres evne til at frigive potente cocktails af immunvirkende mediatorer tillader det perifere nervesystem aktivt at modulere den medfødte immunrespons og koordinere nedstrøms adaptiv immunitet. Omvendt er nociceptorer meget følsomme over for immunmediatorer, som aktiverer og sensibiliserer neuronerne. Neurogen og immunmedieret inflammation er derfor ikke uafhængige enheder, men fungerer sammen som tidlige advarselsanordninger. Det perifere nervesystem spiller dog også en vigtig rolle i patofysiologien og måske ætiologien af mange immunsygdomme som astma, psoriasis eller colitis, fordi dets evne til at aktivere immunsystemet kan forstærke patologisk inflammation 15�17. Behandling af immunsygdomme kan derfor være nødvendigt at omfatte målretning af nociceptorer såvel som af immunceller.
Anerkendelser
Vi takker NIH for støtten (2R37NS039518).
Afslutningsvis�at forstå rollen af neurogen inflammation, når det kommer til værtsforsvar og immunopatologi, er afgørende for at bestemme den korrekte behandlingstilgang til en række sundhedsproblemer i nervesystemet. Ved at se på interaktionerne mellem de perifere neuroner med immunceller, kan sundhedspersonale fremme terapeutiske tilgange for yderligere at hjælpe med at øge værtsforsvaret samt undertrykke immunopatologi. Formålet med artiklen ovenfor er at hjælpe patienter med at forstå neuropatiens kliniske neurofysiologi, blandt andre sundhedsproblemer med nerveskade. Oplysninger refereret fra National Center for Biotechnology Information (NCBI). Omfanget af vores information er begrænset til kiropraktik samt til rygmarvsskader og -tilstande. For at diskutere emnet, er du velkommen til at spørge Dr. Jimenez eller kontakte os på�915-850-0900 .
Kurateret af Dr. Alex Jimenez
Yderligere emner: Rygsmerter
Rygsmerte er en af de mest udbredte årsager til handicap og savnede dage på arbejdspladsen over hele verden. Faktisk er rygsmerter blevet tilskrevet som den næst mest almindelige årsag til doktorkontorbesøg, der kun overstiger luftvejsinfektioner. Ca. 80 procent af befolkningen vil opleve en form for rygsmerter mindst én gang i hele deres liv. Ryggraden er en kompleks struktur bestående af knogler, led, ledbånd og muskler, blandt andet blødt væv. På grund af dette skader og / eller forværrede forhold, som f.eks herniated diske, kan i sidste ende føre til symptomer på rygsmerter. Sportsskader eller personskader er ofte den hyppigste årsag til rygsmerter, men nogle gange kan de enkleste bevægelser have smertefulde resultater. Heldigvis kan alternative behandlingsmuligheder, såsom kiropraktisk pleje, hjælpe lindring af rygsmerter ved brug af rygtilpasninger og manuelle manipulationer, der i sidste ende forbedrer smertelindring.

EKSTRA VIGTIG TEMNE: Håndtering af lænderygsmerter
FLERE EMNER: EKSTRA EKSTRA:�Kroniske smerter og behandlinger
Blank
Referencer
Luk harmonika
Oplysningerne heri om "Rolle af neurogen inflammation" er ikke beregnet til at erstatte et en-til-en-forhold med en kvalificeret sundhedsperson eller autoriseret læge og er ikke medicinsk rådgivning. Vi opfordrer dig til at træffe sundhedsbeslutninger baseret på din forskning og partnerskab med en kvalificeret sundhedsperson.
Bloginformation og diskussioner om omfang
Vores informationsomfang er begrænset til kiropraktik, muskuloskeletal, fysisk medicin, wellness, bidragende ætiologisk viscerosomatiske forstyrrelser inden for kliniske præsentationer, tilhørende somatovisceral refleks klinisk dynamik, subluksationskomplekser, følsomme helbredsproblemer og/eller funktionel medicin artikler, emner og diskussioner.
Vi giver og præsenterer klinisk samarbejde med specialister fra forskellige discipliner. Hver specialist er styret af deres faglige omfang af praksis og deres licensjurisdiktion. Vi bruger funktionelle sundheds- og velværeprotokoller til at behandle og understøtte pleje af skader eller lidelser i bevægeapparatet.
Vores videoer, indlæg, emner, emner og indsigt dækker kliniske forhold, problemstillinger og emner, der relaterer til og direkte eller indirekte understøtter vores kliniske anvendelsesområde.*
Vores kontor har med rimelighed forsøgt at give støttende citater og har identificeret den eller de relevante forskningsundersøgelser, der understøtter vores indlæg. Vi leverer kopier af understøttende forskningsundersøgelser tilgængelige for tilsynsråd og offentligheden efter anmodning.
Vi forstår, at vi dækker forhold, der kræver yderligere forklaring på, hvordan det kan hjælpe med en bestemt plejeplan eller behandlingsprotokol. derfor er du velkommen til at spørge for yderligere at diskutere emnet ovenfor Dr. Alex Jimenez, DC, eller kontakte os på 915-850-0900.
Vi er her for at hjælpe dig og din familie.
Blessings
Dr. Alex Jimenez A.D. MSACP, RN*, CCST, Ifmcp*, CIFM*, ATN*
Email: coach@elpasofunctionalmedicine.com
Licenseret som Doctor of Chiropractic (DC) i Texas & New Mexico*
Texas DC-licensnummer TX5807, New Mexico DC Licensnr. NM-DC2182
Licenseret som registreret sygeplejerske (RN*) in Florida
Florida-licens RN-licens # RN9617241 (Kontrol nr. 3558029)
Kompakt status: Multi-State Licens: Bemyndiget til at praktisere i 40 stater*
Dr. Alex Jimenez DC, MSACP, RN*CIFM*, IFMCP*, ATN*, CCST
Mit digitale visitkort