Ketonlegemer skabes af leveren og bruges som energikilde, når glukose ikke er let tilgængelig i menneskekroppen. De to vigtigste ketonlegemer er acetoacetat (AcAc) og 3-beta-hydroxybutyrat (3HB), mens acetone er det tredje og mindst udbredte ketonlegeme. Ketoner er altid til stede i blodet, og deres niveauer stiger under faste og langvarig træningketogenese er den biokemiske proces, hvormed organismer producerer ketonlegemer gennem nedbrydning af fedtsyrer og ketogene aminosyrer.
Ketonlegemer skabes hovedsageligt i mitokondrier af leverceller. Ketogenese opstår, når der er lave glukoseindhold i blodet, især efter at andre cellulære kulhydratforretninger, såsom glykogen, er blevet opbrugt. Denne mekanisme kan også forekomme, når der ikke er tilstrækkelige mængder insulin. Fremstillingen af ketonlegemer er i sidste ende indledt for at stille tilgængelig energi til rådighed, som er lagret i den menneskelige krop som fedtsyrer. Ketogenese forekommer i mitokondrier, hvor det er uafhængigt reguleret.
Indhold
Abstrakt
Ketonlegemetabolisme er en central knudepunkt i fysiologisk homeostase. I denne gennemgang diskuteres, hvordan ketoner tjener diskrete finjusterende metaboliske roller, der optimerer orgel og organismer ydeevne i varierende næringsstoffer forbliver og beskytter mod betændelse og skade i flere organsystemer. Traditionelt betragtes som metaboliske substrater, der kun er inddraget i kulhydratrestriktioner, understreges de seneste observationer betydningen af ketonlegemer som vigtige metaboliske og signalmediatorer, når kulhydrater er rigelige. Som supplement til et repertoire af kendte terapeutiske muligheder for sygdomme i nervesystemet er der opstået potentielle roller for ketonlegemer i kræft, som har spændende beskyttelsesroller i hjerte og lever, der åbner terapeutiske muligheder i fedme-relateret og hjerte-kar-sygdomme. Kontroverser i ketonmetabolisme og signalering diskuteres for at forene klassisk dogma med nutidige observationer.
Introduktion
Ketonlegemer er en vital alternativ metabolisk brændstofkilde for alle livets domæner, eukarya, bakterier og archaea (Aneja et al., 2002; Cahill GF Jr, 2006; Krishnakumar et al., 2008). Ketonlegememetabolisme hos mennesker er blevet udnyttet til at give næring til hjernen under episodiske perioder med mangel på næringsstoffer. Ketonlegemer er sammenvævet med vigtige pattedyrs metaboliske veje, såsom β-oxidation (FAO), tricarboxylsyrecyklussen (TCA), gluconeogenese, de novo lipogenese (DNL) og biosyntese af steroler. Hos pattedyr produceres ketonstoffer overvejende i leveren fra FAO-afledt acetyl-CoA, og de transporteres til ekstrahepatisk væv til terminal oxidation. Denne fysiologi giver et alternativt brændstof, der forstærkes af relativt korte perioder med faste, hvilket øger fedtsyretilgængeligheden og mindsker kulhydrattilgængeligheden (Cahill GF Jr, 2006; McGarry og Foster, 1980; Robinson og Williamson, 1980). Ketonlegemeoxidation bliver en væsentlig bidragyder til pattedyrs overordnede metabolisme i ekstrahepatisk væv i et utal af fysiologiske tilstande, herunder faste, sult, neonatalperioden, post-motion, graviditet og overholdelse af lavkulhydratdiæter. Cirkulerende samlede ketonlegemekoncentrationer hos raske voksne mennesker udviser normalt døgnsvingninger mellem ca. 100�250�M, stiger til ~1 mM efter langvarig træning eller 24 timers faste og kan akkumuleres til så højt som 20 mM i patologiske tilstande som diabetisk ketoacidose ( Cahill GF Jr, 2006; Johnson et al., 1969b; Koeslag et al., 1980; Robinson og Williamson, 1980; Wildenhoff et al., 1974). Den menneskelige lever producerer op til 300 g ketonlegemer om dagen (Balasse og Fery, 1989), som bidrager med mellem 5-20 % af det samlede energiforbrug i tilstande med mad, faste og sult (Balasse et al., 1978; Cox et al. al., 2016).
Nylige undersøgelser fremhæver nu vigtige roller for ketonlegemer i pattedyrcellemetabolisme, homeostase og signalering under en lang række fysiologiske og patologiske tilstande. Udover at fungere som energibrændstoffer til ekstrahepatiske væv som hjerne-, hjerte- eller skeletmuskulatur, spiller ketonlegemer hovedrolle som signalmediatorer, drivkræfter for protein post-translationel modifikation (PTM) og modulatorer af inflammation og oxidativ stress. I denne anmeldelse giver vi både klassisk og moderne syn på de pleiotropiske roller af ketonlegemer og deres metabolisme.
Oversigt over Ketonlegemetabolisme
Hastigheden af hepatisk ketogenese styres af en orkestreret række fysiologiske og biokemiske transformationer af fedt. Primære regulatorer inkluderer lipolyse af fedtsyrer fra triacylglyceroler, transport til og på tværs af hepatocytplasmamembranen, transport ind i mitokondrier via carnitin palmitoyltransferase 1 (CPT1), a-oxidationsspiralen, TCA-cyklusaktivitet og mellemkoncentrationer, redoxpotentiale og de hormonelle regulatorer af disse processer, overvejende glucagon og insulin [gennemgået i (Arias et al., 1995; Ayte et al., 1993; Ehara et al., 2015; Ferre et al., 1983; Kahn et al., 2005; McGarry and Foster , 1980; Williamson et al., 1969)]. Klassisk betragtes ketogenese som en overløbsvej, hvor a-oxidationsafledt acetyl-CoA overstiger citratsyntaseaktivitet og / eller oxaloacetat-tilgængelighed for kondens til dannelse af citrat. Mellemprodukter med tre carbon udviser anti-ketogen aktivitet, formodentlig på grund af deres evne til at udvide oxaloacetatpuljen til acetyl-CoA-forbrug, men hepatisk acetyl-CoA-koncentration alene bestemmer ikke ketogen hastighed (Foster, 1967; Rawat og Menahan, 1975; Williamson et al., 1969). Reguleringen af ketogenese ved hormonelle, transkriptionelle og post-translationelle begivenheder understøtter sammen tanken om, at de molekylære mekanismer, der finjusterer ketogen hastighed, forbliver ufuldstændigt forstået (se regulering af HMGCS2 og SCOT / OXCT1).
Ketogenese forekommer primært i lever mitokondrie matrix ved hastigheder, der er proportionale med total fedtoxidation. Efter transport af acylkæder over mitokondrie-membranerne og a-oxidation katalyserer mitokondrie-isoformen af 3-hydroxymethylglutaryl-CoA-syntase (HMGCS2) den skæbne, der begår kondensation af acetoacetyl-CoA (AcAc-CoA) og acetyl-CoA for at generere HMG-CoA (Fig. 1A). HMG-CoA lyase (HMGCL) spalter HMG-CoA for at frigøre acetyl-CoA og acetoacetat (AcAc), og sidstnævnte reduceres til d - a - hydroxybutyrat (d-? OHB) ved phosphatidylcholin-afhængig mitokondrie d-a OHB dehydrogenase ( BDH1) i en NAD + / NADH-koblet næsten ligevægtsreaktion (Bock og Fleischer, 1975; LEHNINGER et al., 1960). BDH1-ligevægtskonstant favoriserer d-? OHB-produktion, men forholdet mellem AcAc / d-? OHB-ketonlegemer er direkte proportionalt med mitokondrie NAD + / NADH-forhold, og således modulerer BDH1 oxidoreduktaseaktivitet mitokondrie redox potentiale (Krebs et al., 1969; Williamson et al., 1967). AcAc kan også spontant decarboxylere til acetone (Pedersen, 1929), kilden til sød lugt hos mennesker, der lider af ketoacidose (dvs. samlede serumketonlegemer> ~ 7 mM; AcAc pKa 3.6,? OHB pKa 4.7). Mekanismerne, gennem hvilke ketonlegemer transporteres gennem den mitokondriale indre membran, er ikke kendt, men AcAc / d-a-OHB frigøres fra celler via monocarboxylattransportører (hos pattedyr, MCT 1 og 2, også kendt som opløsningsbærer 16A-familiemedlemmer 1 og 7) og transporteres i cirkulationen til ekstrahepatiske væv til terminal oxidation (Cotter et al., 2011; Halestrap og Wilson, 2012; Halestrap, 2012; Hugo et al., 2012). Koncentrationer af cirkulerende ketonlegemer er højere end i ekstrahepatiske væv (Harrison og Long, 1940), hvilket indikerer, at ketonlegemer transporteres ned i en koncentrationsgradient. Funktionstabsmutationer i MCT1 er forbundet med spontane anfald af ketoacidose, hvilket antyder en kritisk rolle i ketonlegemeimport.
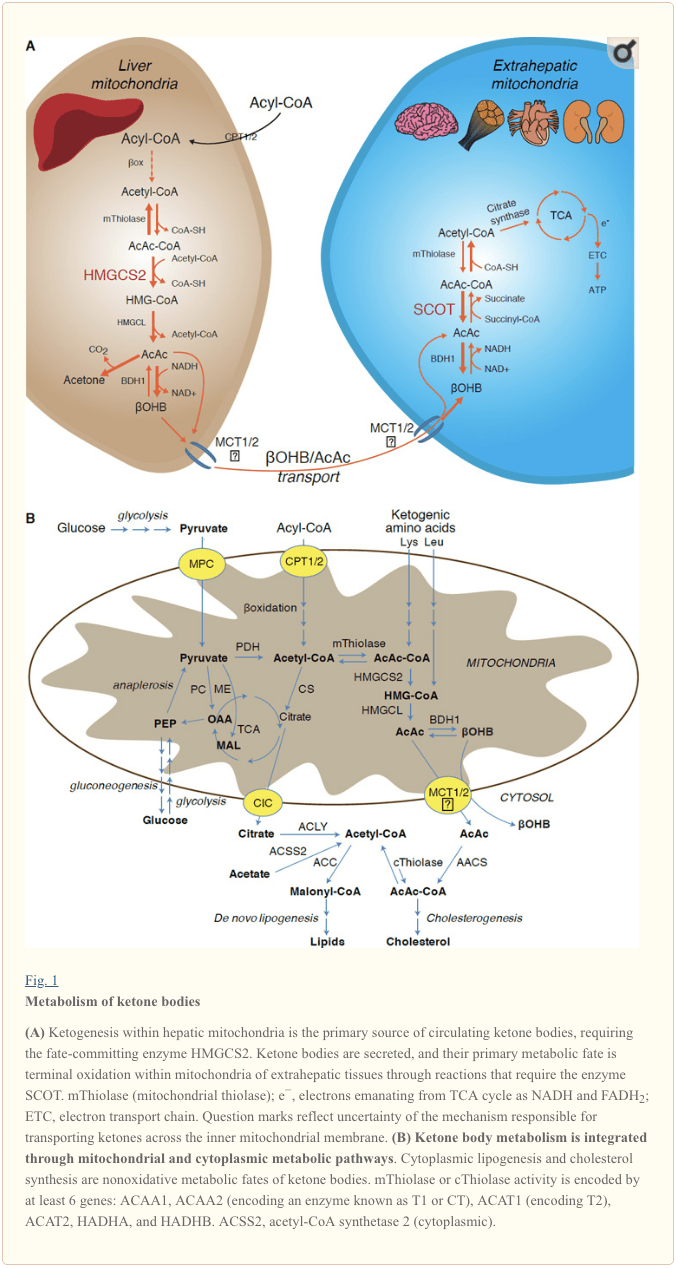
� Med undtagelse af potentiel omledning af ketonstoffer til ikke-oxidative skæbner (se Ikke-oxidative metaboliske skæbner for ketonstoffer), mangler hepatocytter evnen til at metabolisere de ketonstoffer, de producerer. Ketonlegemer syntetiseret de novo af leveren er (i) kataboliseret i mitokondrier i ekstrahepatisk væv til acetyl-CoA, som er tilgængelig for TCA-cyklussen til terminal oxidation (fig. 1A), (ii) omdirigeret til lipogenese- eller sterolsyntesevejene ( Fig. 1B), eller (iii) udskilles i urinen. Som et alternativt energetisk brændstof oxideres ketonlegemer ivrigt i hjerte, skeletmuskulatur og hjerne (Balasse og Fery, 1989; Bentourkia et al., 2009; Owen et al., 1967; Reichard et al., 1974; Sultan, 1988 ). Ekstrahepatisk mitokondriel BDH1 katalyserer den første reaktion af OHB-oxidation og omdanner den til back-AcAc (LEHNINGER et al., 1960; Sandermann et al., 1986). En cytoplasmatisk d-OHB-dehydrogenase (BDH2) med kun 20 % sekvensidentitet med BDH1 har en høj Km for ketonstoffer og spiller også en rolle i jernhomeostase (Davuluri et al., 2016; Guo et al., 2006) . I ekstrahepatisk mitokondriel matrix aktiveres AcAc til AcAc-CoA gennem udveksling af en CoA-del fra succinyl-CoA i en reaktion katalyseret af en unik pattedyrs CoA-transferase, succinyl-CoA:3-oxoacid-CoA-transferase (SCOT, CoA-transferase; kodet af OXCT1), gennem en næsten ligevægtsreaktion. Den frie energi frigivet ved hydrolyse af AcAc-CoA er større end den af succinyl-CoA, hvilket fremmer AcAc-dannelse. Således opstår ketonlegemets oxidative flux på grund af massevirkning: en rigelig forsyning af AcAc og hurtigt forbrug af acetyl-CoA gennem citratsyntase fremmer AcAc-CoA (+ succinat) dannelse af SCOT. Især, i modsætning til glucose (hexokinase) og fedtsyrer (acyl-CoA-syntetaser), kræver aktivering af ketonstoffer (SCOT) til en oxiderbar form ikke investering af ATP. En reversibel AcAc-CoA thiolasereaktion [katalyseret af en af de fire mitokondrielle thiolaser kodet af enten ACAA2 (koder for et enzym kendt som T1 eller CT), ACAT1 (koder for T2), HADHA eller HADHB] giver to molekyler af acetyl-CoA, som indgår i TCA-cyklussen (Hersh og Jencks, 1967; Stern et al., 1956; Williamson et al., 1971). Under ketotiske tilstande (dvs. totale serumketoner > 500 �M) bliver ketonlegemer væsentlige bidragydere til energiforbruget og udnyttes hurtigt i væv, indtil optagelse eller mætning af oxidation finder sted (Balasse et al., 1978; Balasse og Fery, 1989 Edmond et al., 1987). En meget lille del af leverafledte ketonstoffer kan let måles i urinen, og udnyttelse og reabsorptionshastigheder i nyrerne er proportionale med cirkulerende koncentration (Goldstein, 1987; Robinson og Williamson, 1980). Under stærkt ketotiske tilstande (> 1 mM i plasma) tjener ketonuri som en semi-kvantitativ reporter af ketose, selvom de fleste kliniske assays af urinketonlegemer påviser AcAc, men ikke ?OHB (Klocker et al., 2013).
Ketogene substrat og deres indvirkning på hepatocyt metabolisme
Ketogene substrater indbefatter fedtsyrer og aminosyrer (fig. 1B). Katabolismen af aminosyrer, især leucin, genererer omkring 4% af ketonlegemer i postabsorberende tilstand (Thomas et al., 1982). Således er acetyl-CoA-substratpuljen til dannelse af ketonlegemer hovedsagelig afledt af fedtsyrer, fordi pyruvat i løbet af tilstande med nedsat kulhydrattilførsel indtræder i den hepatiske TCA-cyklus primært via anaplerose, dvs. ATP-afhængig carboxylation til oxaloacetat (OAA) eller til malat (MAL) og ikke oxidativ decarboxylering til acetyl-CoA (Jeoung et al., 2012; Magnusson et al., 1991; Merritt et al., 2011). I lever, bidrager glucose og pyruvat forsvindende med ketogenese, selv når pyruvatdecarboxylering til acetyl-CoA er maksimal (Jeoung et al., 2012).
Acetyl-CoA udgår adskillige roller integreret i metabolisme i leverformidlet ud over ATP-generationen via terminal oxidation (se også Integrationen af ketonkropsmetabolismen, posttranslationel modifikation og cellefysiologi). Acetyl-CoA aktiverer allosterisk (i) pyruvatcarboxylase (PC) og derved aktiverer en metabolisk kontrolmekanisme, som øger anaplerotisk indgang af metabolitter i TCA-cyklen (Owen et al., 2002, Scrutton and Utter, 1967) og (ii) pyruvatdehydrogenase kinase, som phosphorylerer og inhiberer pyruvatdehydrogenase (PDH) (Cooper et al., 1975), hvorved yderligere flow af pyruvat øges i TCA-cyklen via anaplerose. Endvidere katalyserer cytoplasmatisk acetyl-CoA, hvis pool forstærkes af mekanismer, der omdanner mitokondrialt acetyl-CoA til transportable metabolitter, hæmmer fedtsyreoxidation: acetyl-CoA carboxylase (ACC) katalyserer omdannelsen af acetyl-CoA til malonyl-CoA, det lipogene substrat og allosterisk hæmmer af mitokondrie CPT1 [gennemgået i (Kahn et al., 2005; McGarry og Foster, 1980)]. Således regulerer mitokondrieacetyl-CoA-puljen begge og reguleres af spildningsvejen for ketogenese, som orkestrerer nøgleaspekter af metabolisk metabolisme i leveren.
Ikke-Oxidative Metabolske Fates af Ketonlegemer
Den overvejende skæbne af leverafledte ketoner er SCOT-afhængig ekstrahepatisk oxidation. AcAc kan imidlertid eksporteres fra mitokondrier og anvendes i anabolske veje via omdannelse til AcAc-CoA ved en ATP-afhængig reaktion katalyseret af cytoplasmatisk acetoacetyl-CoA-syntetase (AACS, Fig. 1B). Denne vej er aktiv under hjernens udvikling og i lakterende brystkirtlen (Morris, 2005; Robinson og Williamson, 1978; Ohgami et al., 2003). AACS udtrykkes også stærkt i fedtvæv og aktiverede osteoklaster (Aguilo et al., 2010; Yamasaki et al., 2016). Cytoplasmisk AcAc-CoA kan enten styres af cytosolisk HMGCS1 mod sterolbiosyntese eller spaltes af enten to cytoplasmiske thiolaser til acetyl-CoA (ACAA1 og ACAT2), carboxyleret til malonyl-CoA og bidrager til syntese af fedtsyrer (Bergstrom et al., 1984; Edmond, 1974; Endemann et al., 1982; Geelen et al., 1983; Webber og Edmond, 1977).
Mens den fysiologiske betydning endnu ikke er fastslået, kan ketoner tjene som anabolske substrater selv i leveren. I kunstige eksperimentelle sammenhænge kan AcAc bidrage til så meget som halvdelen af nysyntetiseret lipid og op til 75% af nyt syntetiseret kolesterol (Endemann et al., 1982; Geelen et al., 1983; Freed et al., 1988). Fordi AcAc er afledt af ufuldstændig leverfedtoxidation, ville AcAc's evne til at bidrage til lipogenese in vivo indebære hepatisk forgæves cyklus, hvor fedtafledte ketoner kan bruges til lipidproduktion, en forestilling hvis fysiologiske betydning kræver eksperimentel validering, men kunne tjene adaptive eller utilpassede roller (Solinas et al., 2015). AcAc leverer ivrigt kolesterogenese med en lav AACS Km-AcAc (~50 �M), der favoriserer AcAc-aktivering selv i fødetilstand (Bergstrom et al., 1984). Den dynamiske rolle af cytoplasmatisk ketonmetabolisme er blevet foreslået i primære museembryonale neuroner og i 3T3-L1-afledte adipocytter, da AACS knockdown svækkede differentiering af hver celletype (Hasegawa et al., 2012a; Hasegawa et al., 2012b). Nedbrydning af AACS i mus in vivo reducerede serumkolesterol (Hasegawa et al., 2012c). SREBP-2, en master transkriptionel regulator af kolesterolbiosyntese og peroxisomproliferatoraktiveret receptor (PPAR)-? er AACS transkriptionelle aktivatorer og regulerer dets transkription under neuritudvikling og i leveren (Aguilo et al., 2010; Hasegawa et al., 2012c). Tilsammen kan cytoplasmatisk ketonlegememetabolisme være vigtig i udvalgte tilstande eller sygdomsnaturhistorier, men er utilstrækkelige til at skille sig af med leverafledte ketonstoffer, da massiv hyperketonemi forekommer i forbindelse med selektiv svækkelse af den primære oxidative skæbne via tab af funktionsmutationer til SCOT (Berry et al., 2001; Cotter et al., 2011).
Regulering af HMGCS2 og SCOT / OXCT1
Divergensen af et mitokondrium fra genet, der koder for cytosolisk HMGCS, forekom tidligt i udviklingen af hvirveldyr på grund af behovet for at understøtte leverketogenese hos arter med højere hjerne til kropsvægtforhold (Boukaftane et al., 1994, Cunnane og Crawford, 2003). Naturligt forekommende HMGCS2-mutationer i tab af funktion forårsager forekomster af hypoketotisk hypoglykæmi (Pitt et al., 2015; Thompson et al., 1997). Robust HMGCS2-ekspression er begrænset til hepatocytter og colonepitel, og dets ekspression og enzymatiske aktivitet koordineres gennem forskellige mekanismer (Mascaro et al., 1995; McGarry og Foster, 1980; Robinson og Williamson, 1980). Mens det fulde omfang af fysiologiske tilstande, der påvirker HMGCS2, kræver yderligere belysning, reguleres dets ekspression og / eller aktivitet i den tidlige postnatale periode, aldring, diabetes, sult eller indtagelse af ketogen kost (Balasse og Fery, 1989; Cahill GF Jr, 2006 ; Girard et al., 1992; Hegardt, 1999; Satapati et al., 2012; Sengupta et al., 2010). Hos fosteret korrelerer methylering af 5� flankerende region af Hmgcs2-genet omvendt med dets transkription og vendes delvist efter fødslen (Arias et al., 1995; Ayte et al., 1993; Ehara et al., 2015; Ferre et al. ., 1983). På samme måde udviser hepatisk Bdh1 et udviklingsmæssigt ekspressionsmønster, der stiger fra fødsel til fravænning, og induceres også ved ketogen diæt på en fibroblastvækstfaktor (FGF) -21-afhængig måde (Badman et al., 2007, Zhang et al., 1989 ). Ketogenese hos pattedyr er yderst lydhør over for både insulin og glucagon, henholdsvis undertrykt og stimuleret (McGarry og Foster, 1977). Insulin undertrykker fedtvævslipolyse og fratager således ketogenese af dets substrat, mens glucagon øger ketogen flux gennem en direkte virkning på leveren (Hegardt, 1999). Hmgcs2 transkription stimuleres af forkhead transkriptionsfaktor FOXA2, som hæmmes via insulin-phosphatidylinositol-3-kinase / Akt, og induceres ved glucagon-cAMP-p300-signalering (Arias et al., 1995; Hegardt, 1999; Quant et al. 1990; Thumelin et al., 1993; von Meyenn et al., 2013; Wolfrum et al., 2004; Wolfrum et al., 2003). PPAR? (Rodriguez et al., 1994) sammen med sit mål, FGF21 (Badman et al., 2007), inducerer også Hmgcs2-transkription i leveren under sult eller administration af ketogen diæt (Badman et al., 2007; Inagaki et al., 2007 ). Induktion af PPAR? kan forekomme før overgangen fra føtal til neonatal fysiologi, mens FGF21-aktivering kan foretrækkes i den tidlige neonatale periode via? OHB-medieret hæmning af histondeacetylase (HDAC) -3 (Rando et al., 2016). mTORC1 (pattedyrsmål for rapamycin kompleks 1) afhængig hæmning af PPAR? transkriptionsaktivitet er også en nøgleregulator for Hmgcs2-genekspression (Sengupta et al., 2010), og lever PER2, en mestersirkadisk oscillator, regulerer indirekte Hmgcs2-ekspression (Chavan et al., 2016). Nylige observationer indikerer, at ekstrahepatisk tumorinduceret interleukin-6 forringer ketogenese via PPAR? undertrykkelse (Flint et al., 2016).
HMGCS2 enzymaktivitet reguleres gennem flere PTM'er. HMGCS2 serinphosphorylering forøgede sin aktivitet in vitro (Grimsrud et al., 2012). HMGCS2-aktivitet inhiberes allosterisk af succinyl-CoA og lysinrestsuccinylering (Arias et al., 1995; Hegardt, 1999; Lowe og Tubbs, 1985; Quant et al., 1990; Rardin et al., 2013; Reed et al., 1975; Thumelin et al., 1993). Succinylering af HMGCS2-, HMGCL- og BDH1-lysinrester i levermitokondrier er mål for den NAD + -afhængige deacylase sirtuin 5 (SIRT5) (Rardin et al., 2013). HMGCS2-aktivitet forbedres også ved SIRT3-lysin-deacetylering, og det er muligt, at crosstalk mellem acetylering og succinylering regulerer HMGCS2-aktivitet (Rardin et al., 2013, Shimazu et al., 2013). På trods af disse PTMs evne til at regulere HMGCS2 Km og Vmax er svingninger af disse PTM'er endnu ikke blevet omhyggeligt kortlagt og er ikke blevet bekræftet som mekaniske drivkræfter for ketogenese in vivo.
SCOT udtrykkes i alle pattedyrceller, der bærer mitokondrier, undtagen de af hepatocytter. Vigtigheden af SCOT-aktivitet og ketolyse blev påvist i SCOT-KO-mus, som udviser ensartet dødelighed på grund af hyperketonemisk hypoglykæmi inden for 48h efter fødslen (Cotter et al., 2011). Vævsspecifik tab af SCOT i neuroner eller skelettmyocytter inducerer metaboliske abnormiteter under sult, men er ikke dødelig (Cotter et al., 2013b). Hos mennesker lever SCOT-mangel tidligt i livet med alvorlig ketoacidose, hvilket forårsager letargi, opkastning og koma (Berry et al., 2001; Fukao et al., 2000; Kassovska-Bratinova et al., 1996; Niezen-Koning et al. , 1997; Saudubray et al., 1987; Snyderman et al., 1998; Tildon og Cornblath, 1972). Forholdsvis lille er kendt på cellulær niveau omkring SCOT-gen og proteinekspressionsregulatorer. Oxct1 mRNA-ekspression og SCOT-protein og -aktivitet formindskes i ketotiske tilstande, muligvis gennem PPAR-afhængige mekanismer (Fenselau og Wallis, 1974, Fenselau og Wallis, 1976; Grinblat et al., 1986; Okuda et al., 1991; Turko et al. ., 2001; Wentz et al., 2010). Ved diabetisk ketoacidose bliver mismatchen mellem leverketogenese og ekstrahepatisk oxidation forværret ved nedsættelse af SCOT-aktivitet. Overekspression af insulinuafhængig glucosetransportør (GLUT1 / SLC2A1) i kardiomyocytter hæmmer også Oxct1-genekspression og nedregulerer ketones terminal oxidation i ikke-ketotisk tilstand (Yan et al., 2009). I leveren undertrykkes Oxct1 mRNA-overfladen af microRNA-122 og histon-methylering H3K27me3, som er tydelige under overgangen fra føtal til nyfødt periode (Thorrez et al., 2011). Imidlertid er undertrykkelse af hepatisk Oxct1-ekspression i postnatale perioden primært henført til evakueringen af Oxct1-udtrykkende hæmatopoietiske stamceller fra leveren, snarere end et tab af tidligere eksisterende Oxct1-ekspression i terminalt differentierede hepatocytter. Faktisk er ekspression af Oxct1 mRNA og SCOT protein i differentierede hepatocytter ekstremt lave (Orii et al., 2008).
SCOT er også reguleret af PTM'er. Enzymet er hyperacetyleret i hjerner fra SIRT3 KO-mus, som også udviser nedsat AcAc-afhængig acetyl-CoA-produktion (Dittenhafer-Reed et al., 2015). Ikke-enzymatisk nitrering af tyrosinrester af SCOT dæmper også dens aktivitet, hvilket er blevet rapporteret i hjerter fra forskellige diabetiske musemodeller (Marcondes et al., 2001; Turko et al., 2001; Wang et al., 2010a). I modsætning hertil øger nitrering af tryptofan-rester SCOT-aktivitet (Br�g�re et al., 2010; Rebrin et al., 2007). Molekylære mekanismer for restspecifik nitrering eller denitrering designet til at modulere SCOT-aktivitet kan eksistere og kræve belysning.
Kontroverser i ekstrahepatisk ketogenese
Hos pattedyr er det primære ketogene organ lever, og kun hepatocytter og tarmepitelceller udtrykker i rigelige mængder den mitokondrielle isoform af HMGCS2 (Cotter et al., 2013a; Cotter et al., 2014; McGarry og Foster, 1980; Robinson og Williamson, 1980) . Anaerob bakteriel fermentering af komplekse polysaccharider giver butyrat, som absorberes af colonocytter hos pattedyr til terminal oxidation eller ketogenese (Cherbuy et al., 1995), som kan spille en rolle i colonocytdifferentiering (Wang et al., 2016). Med undtagelse af tarmepitelceller og hepatocytter er HMGCS2 næsten fraværende i næsten alle andre pattedyrceller, men udsigten til ekstrahepatisk ketogenese er blevet øget i tumorceller, astrocytter i centralnervesystemet, nyrerne, bugspytkirtel ? celler, retinalt pigmentepitel (RPE) og endda i skeletmuskulatur (Adijanto et al., 2014; Avogaro et al., 1992; El Azzouny et al., 2016; Grabacka et al., 2016; Kang et al., 2015 ; Le Foll et al., 2014; Nonaka et al., 2016; Takagi et al., 2016a; Thevenet et al., 2016; Zhang et al., 2011). Ektopisk HMGCS2 er blevet observeret i væv, der mangler netto ketogen kapacitet (Cook et al., 2016; Wentz et al., 2010), og HMGCS2 udviser prospektive ketogenese-uafhængige "moonlighting"-aktiviteter, herunder inden for cellekernen (Chen et al. , 2016; Kostiuk et al., 2010; Meertens et al., 1998).
Ethvert ekstrahepatisk væv, der oxiderer ketonlegemer, har også potentialet til at akkumulere ketonlegemer via HMGCS2-uafhængige mekanismer (figur 2A). Der er dog ikke noget ekstrahepatisk væv, hvor en steady state ketonkropskoncentration overstiger den i cirkulationen (Cotter et al., 2011; Cotter et al., 2013b; Harrison og Long, 1940), hvilket understreger, at ketonlegemer transporteres ned ad en koncentrationsgradient via MCT1 / 2-afhængige mekanismer. En mekanisme for tilsyneladende ekstrahepatisk ketogenese kan faktisk afspejle relativ svækkelse af ketonoxidation. Yderligere potentielle forklaringer falder inden for dannelsen af ketonlegemer. For det første kan de novo ketogenese forekomme via reversibel enzymatisk aktivitet af thiolase og SCOT (Weidemann og Krebs, 1969). Når koncentrationen af acetyl-CoA er relativt høj, fungerer reaktioner, der normalt er ansvarlige for AcAc-oxidation i omvendt retning (GOLDMAN, 1954). En anden mekanisme opstår, når a-oxidationsafledte mellemprodukter akkumuleres på grund af en TCA-cyklusflaskehals, AcAc-CoA omdannes til l-? OHB-CoA gennem en reaktion katalyseret af mitokondrie 3-hydroxyacyl-CoA-dehydrogenase og yderligere ved 3-hydroxybutyryl CoA-deacylase til l-? OHB, som ikke kan skelnes ved massespektrometri eller resonansspektroskopi fra den fysiologiske enantiomer d-? OHB (Reed og Ozand, 1980). l-? OHB kan skelnes kromatografisk eller enzymatisk fra d-? OHB og er til stede i ekstrahepatisk væv, men ikke i lever eller blod (Hsu et al., 2011). Hepatisk ketogenese producerer kun d-? OHB, den eneste enantiomer, der er et BDH-substrat (Ito et al., 1984; Lincoln et al., 1987; Reed og Ozand, 1980; Scofield et al., 1982; Scofield et al., 1982). En tredje HMGCS2-uafhængig mekanisme genererer d-? OHB gennem aminosyrekatabolisme, især leucin og lysin. En fjerde mekanisme er kun synlig, fordi den skyldes en mærkningsgenstand og således betegnes som pseudoketogenese. Dette fænomen kan tilskrives reversibiliteten af SCOT- og thiolasereaktionerne og kan forårsage overvurdering af ketonlegemsomsætningen på grund af den isotopiske fortynding af ketonlegemsporeren i ekstrahepatisk væv (Des Rosiers et al., 1990; Fink et al., 1988) . Ikke desto mindre kan pseudoketogenese være ubetydelig i de fleste sammenhænge (Bailey et al., 1990; Keller et al., 1978). En skematisk skema (fig. 2A) indikerer en nyttig fremgangsmåde til anvendelse under overvejelse af forhøjet vævssteady-koncentration af ketoner.
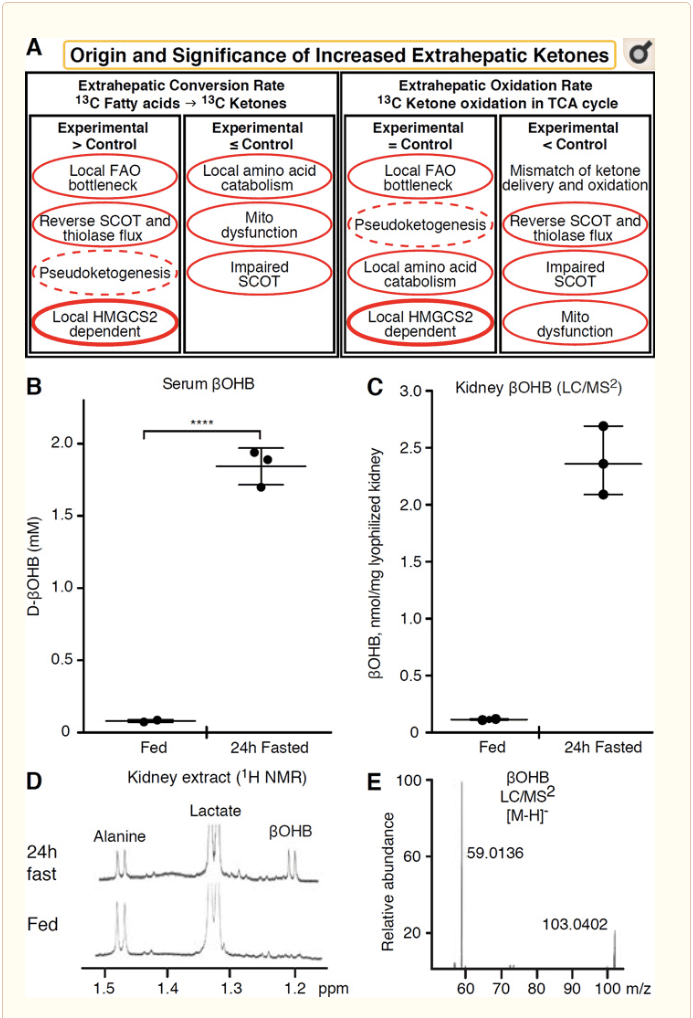

� Nyre har for nylig fået opmærksomhed som et potentielt ketogent organ. I langt de fleste stater er nyren en nettoforbruger af leverafledte ketonstoffer, der udskiller eller reabsorberer ketonstoffer fra blodbanen, og nyrerne er generelt ikke en nettoketonlegemegenerator eller -koncentrator (Robinson og Williamson, 1980). Forfatterne af en klassisk undersøgelse konkluderede, at minimal renal ketogenese kvantificeret i et kunstigt eksperimentelt system ikke var fysiologisk relevant (Weidemann og Krebs, 1969). For nylig er nyreketogenese blevet udledt i diabetiske og autofagi-deficiente musemodeller, men det er mere sandsynligt, at multiorganskift i metabolisk homeostase ændrer integrativ ketonmetabolisme gennem input på flere organer (Takagi et al., 2016a; Takagi et al., 2016b; Zhang et al., 2011). En nylig publikation foreslog renal ketogenese som en beskyttende mekanisme mod iskæmi-reperfusionsskade i nyren (Tran et al., 2016). Absolutte steady state-koncentrationer af ?OHB fra ekstrakter af musenyrevæv blev rapporteret ved ~4~12 mM. For at teste, om dette var holdbart, kvantificerede vi ?OHB-koncentrationer i nyreekstrakter fra fodrede og 24 timers fastende mus. Serum-OHB-koncentrationer steg fra ~100 �M til 2 mM med 24 timers faste (fig. 2B), mens steady-state OHB-koncentrationer i nyrerne ca. 100 �M i fødetilstand og kun 1 mM i 24 timers fastende tilstand (fig. 2C�E), observationer, der er i overensstemmelse med koncentrationer kvantificeret for over 45 år siden (Hems og Brosnan, 1970). Det er fortsat muligt, at leverafledte ketonlegemer i ketotiske tilstande kan være genbeskyttende, men beviser for renal ketogenese kræver yderligere underbyggelse. Overbevisende beviser, der understøtter ægte ekstrahepatisk ketogenese, blev præsenteret i RPE (Adijanto et al., 2014). Denne spændende metaboliske transformation blev foreslået for potentielt at tillade RPE-afledte ketoner at strømme til fotoreceptor- eller M�ller glia-celler, hvilket kunne hjælpe med regenereringen af fotoreceptorens ydre segment.
? OHB som signalformidler
Selvom de er energirigt rige, udøver ketonlegemer provokerende "ikke-kanoniske" signaleringsroller i cellulær homeostase (Fig. 3) (Newman og Verdin, 2014; Rojas-Morales et al., 2016). For eksempel hæmmer ?OHB Klasse I HDAC'er, hvilket øger histonacetylering og derved inducerer ekspressionen af gener, der begrænser oxidativt stress (Shimazu et al., 2013). ?OHB i sig selv er en histon kovalent modifikator på lysinrester i leveren af fastende eller streptozotocin-inducerede diabetiske mus (Xie et al., 2016) (se også nedenfor, Integration af ketonlegememetabolisme, post-translationel modifikation og cellefysiologi, og Ketonlegemer, oxidativt stress og neurobeskyttelse).
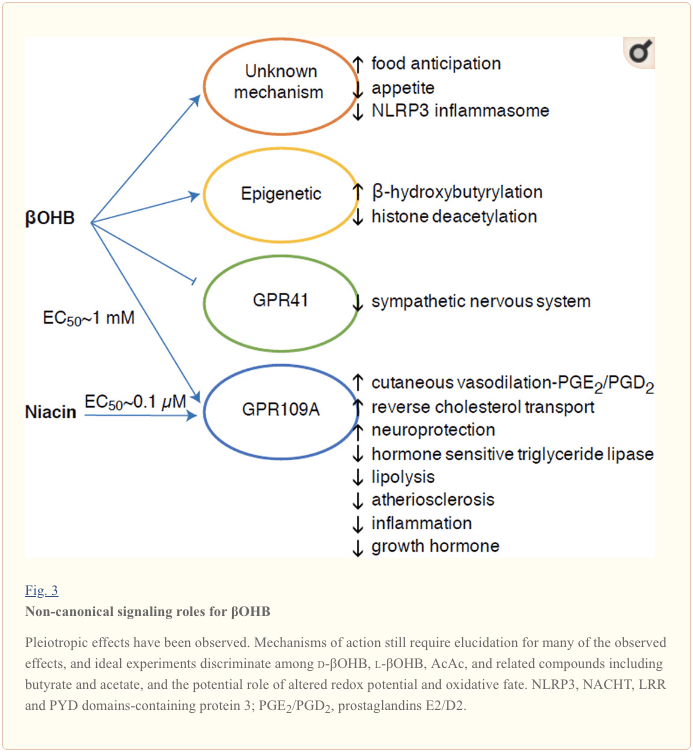
?OHB er også en effektor via G-protein koblede receptorer. Gennem uklare molekylære mekanismer undertrykker det sympatisk nervesystems aktivitet og reducerer det samlede energiforbrug og hjertefrekvens ved at hæmme kortkædet fedtsyresignalering gennem G-proteinkoblet receptor 41 (GPR41) (Kimura et al., 2011). En af de mest undersøgte signaleffekter af ?OHB fortsætter gennem GPR109A (også kendt som HCAR2), et medlem af hydrocarboxylsyre-GPCR-underfamilien udtrykt i fedtvæv (hvidt og brunt) (Tunaru et al., 2003) og i immunceller (Ahmed et al., 2009). ?OHB er den eneste kendte endogene ligand af GPR109A-receptoren (EC50 ~770 �M) aktiveret af d-?OHB, l-?OHB og butyrat, men ikke AcAc (Taggart et al., 2005). Den høje koncentrationstærskel for GPR109A-aktivering opnås gennem overholdelse af en ketogen diæt, sult eller under ketoacidose, hvilket fører til hæmning af fedtvævslipolyse. Den anti-lipolytiske virkning af GPR109A fortsætter gennem inhibering af adenylylcyclase og nedsat cAMP, hvilket hæmmer hormonfølsom triglyceridlipase (Ahmed et al., 2009; Tunaru et al., 2003). Dette skaber en negativ feedback-loop, hvor ketose sætter en modulerende bremse på ketogenesen ved at mindske frigivelsen af ikke-esterificerede fedtsyrer fra adipocytter (Ahmed et al., 2009; Taggart et al., 2005), en effekt der kan opvejes af den sympatiske drift, der stimulerer lipolysen. Niacin (vitamin B3, nikotinsyre) er en potent (EC50 ~ 0.1 �M) ligand for GRP109A, som er effektivt anvendt i årtier mod dyslipidæmi (Benyo et al., 2005; Benyo et al., 2006; Fabbrini et al., 2010a; Lukasova et al., 2011; Tunaru et al., 2003). Mens niacin øger omvendt kolesteroltransport i makrofager og reducerer aterosklerotiske læsioner (Lukasova et al., 2011), forbliver virkningerne af ?OHB på aterosklerotiske læsioner ukendte. Selvom GPR109A-receptoren udøver beskyttende roller, og der eksisterer spændende forbindelser mellem brug af ketogen diæt i slagtilfælde og neurodegenerative sygdomme (Fu et al., 2015; Rahman et al., 2014), er en beskyttende rolle for ?OHB via GPR109A ikke blevet påvist in vivo .
Endelig kan OHB påvirke appetit og mæthed. En meta-analyse af undersøgelser, der målte virkningerne af ketogene diæter og diæter med meget lav energi, konkluderede, at deltagere, der indtager disse diæter, udviser højere mæthed sammenlignet med kontroldiæter (Gibson et al., 2015). Men en plausibel forklaring på denne effekt er de yderligere metaboliske eller hormonelle elementer, der kan modulere appetitten. For eksempel udviste mus, der blev holdt på en gnaver ketogen diæt, øget energiforbrug sammenlignet med foderkontrol-fodrede mus, på trods af lignende kalorieindtag, og cirkulerende leptin eller gener af peptider, der regulerer fodringsadfærd, blev ikke ændret (Kennedy et al., 2007). Blandt de foreslåede mekanismer, der tyder på appetitundertrykkelse af ?OHB, omfatter både signalering og oxidation (Laeger et al., 2010). Hepatocytspecifik deletion af døgnrytme-genet (Per2) og kromatin-immunpræcipitationsundersøgelser afslørede, at PER2 direkte aktiverer Cpt1a-genet og indirekte regulerer Hmgcs2, hvilket fører til svækket ketose i Per2 knockout-mus (Chavan et al., 2016). Disse mus udviste svækket madforventning, som delvist blev genoprettet ved systemisk ?OHB-administration. Fremtidige undersøgelser vil være nødvendige for at bekræfte centralnervesystemet som et direkte ?OHB-mål, og om ketonoxidation er nødvendig for de observerede effekter, eller om en anden signalmekanisme er involveret. Andre efterforskere har påberåbt sig muligheden for lokal astrocyt-afledt ketogenese i den ventromediale hypothalamus som en regulator af fødeindtagelse, men disse foreløbige observationer vil også drage fordel af genetiske og flux-baserede vurderinger (Le Foll et al., 2014). Forholdet mellem ketose og næringsstofmangel er fortsat interessant, fordi sult og mæthed er vigtige elementer i mislykkede vægttabsforsøg.
Integration af Ketonlegemetabolisme, Post-Translational Modifikation, og Cell Physiology
Ketonlegemer bidrager til compartmentaliserede pools af acetyl-CoA, et nøglemellemprodukt, der udviser fremtrædende roller i cellulær metabolisme (Pietrocola et al., 2015). En rolle acetyl-CoA er at tjene som et substrat for acetylering, en enzymatisk katalyseret histonkovalent modifikation (Choudhary et al., 2014; Dutta et al., 2016; Fan et al., 2015; Menzies et al., 2016 ). Et stort antal dynamisk acetylerede mitochondriale proteiner, hvoraf mange kan forekomme gennem ikke-enzymatiske mekanismer, har også fremkommet fra beregningsproteomikstudier (Dittenhafer-Reed et al., 2015; Hebert et al., 2013; Rardin et al., 2013 Shimazu et al., 2010). Lysin-deacetylaser bruger en zinkkofaktor (fx nukleocytosoliske HDAC'er) eller NAD + som co-substrat (sirtuiner, SIRT'er) (Choudhary et al., 2014; Menzies et al., 2016). Acetylproteomet tjener som både sensor og effektor af den totale cellulære acetyl-CoA-pool, da fysiologiske og genetiske manipulationer hver især resulterer i ikke-enzymatiske globale variationer af acetylering (Weinert et al., 2014). Da intracellulære metabolitter tjener som modulatorer for acetylering af lysinrest, er det vigtigt at overveje ketonorganernes rolle, hvis overflade er yderst dynamisk.
OHB er en epigenetisk modifikator gennem mindst to mekanismer. Øgede OHB-niveauer induceret ved faste, kaloribegrænsning, direkte administration eller langvarig træning fremkalder HDAC-hæmning eller histonacetyltransferase-aktivering (Marosi et al., 2016; Sleiman et al., 2016) eller til oxidativ stress (Shimazu et al., 2013) . OHB-hæmning af HDAC3 kunne regulere nyfødt metabolisk fysiologi (Rando et al., 2016). Uafhængigt ændrer? OHB selv histonlysinrester direkte (Xie et al., 2016). Langvarig faste eller steptozotocin-induceret diabetisk ketoacidose øgede histon-a-hydroxybutyrylering. Selvom antallet af lysin-a-hydroxybutyrylering- og acetyleringssteder var sammenlignelige, blev der observeret støkiometrisk større histon-a-hydroxybutyrylering end acetylering. Tydelige gener blev påvirket af histonlysin-a-hydroxybutyrylering versus acetylering eller methylering, hvilket antydede forskellige cellulære funktioner. Om a-hydroxybutyrylering er spontan eller enzymatisk vides ikke, men udvider rækkevidden af mekanismer gennem ketonlegemer, der dynamisk påvirker transkription.
Væsentlige celleomprogrammeringshændelser under kaloribegrænsning og næringsstofnedsættelse kan formidles i henholdsvis SIRT3- og SIRT5-afhængig mitokondrie-deacetylering og desuccinylering, hvilket regulerer ketogene og ketolytiske proteiner på posttranslationelt niveau i lever- og ekstrahepatisk væv (Dittenhafer-Reed et al., 2015; Hebert et al., 2013; Rardin et al., 2013; Shimazu et al., 2010). Selvom støkiometrisk sammenligning af besatte steder ikke nødvendigvis knytter sig direkte til forskydninger i metabolisk flux, er mitokondrieacetylering dynamisk og kan drives af acetyl-CoA-koncentration eller mitokondrie-pH snarere end enzymatiske acetyltransferaser (Wagner og Payne, 2013). At SIRT3 og SIRT5 modulerer aktiviteter af ketonlegemer, der metaboliserer enzymer, fremkalder spørgsmålet om ketonernes gensidige rolle i skulptur af acetylproteom, succinylproteom og andre dynamiske cellulære mål. Da variationer af ketogenese afspejler NAD + -koncentrationer, kunne ketonproduktion og overflod faktisk regulere sirtuinaktivitet og derved påvirke total acetyl-CoA / succinyl-CoA-puljer, acylproteomet og dermed mitokondrie- og cellefysiologi. a-hydroxybutyrylering af enzymlysinrester kunne tilføje endnu et lag til cellulær omprogrammering. I ekstrahepatisk væv kan ketonlegemeoxidation stimulere analoge ændringer i cellehomeostase. Mens opdeling af acetyl-CoA-puljer er stærkt reguleret og koordinerer et bredt spektrum af cellulære ændringer, kræver ketonlegemers evne til direkte at forme både mitokondrie- og cytoplasmatiske acetyl-CoA-koncentrationer belysning (Chen et al., 2012; Corbet et al., 2016; Pougovkina et al., 2014; Schwer et al., 2009; Wellen og Thompson, 2012). Fordi acetyl-CoA-koncentrationer er tæt reguleret, og acetyl-CoA er membranimpermeant, er det afgørende at overveje drivmekanismerne, der koordinerer acetyl-CoA-homeostase, herunder produktionshastigheder og terminal oxidation i TCA-cyklussen, omdannelse til ketonlegemer, mitokondrie udstrømning via carnitinacetyltransferase (CrAT) eller acetyl-CoA-eksport til cytosol efter omdannelse til citrat og frigivelse ved ATP-citratlyase (ACLY). Nøglerollerne for disse sidstnævnte mekanismer i celleacetylproteom og homeostase kræver matchet forståelse af rollerne for ketogenese og ketonoxidation (Das et al., 2015; McDonnell et al., 2016; Moussaieff et al., 2015; Overmyer et al., 2015; Seiler et al., 2014; Seiler et al., 2015; Wellen et al., 2009; Wellen and Thompson, 2012). Konvergente teknologier inden for metabolomics og acylproteomics i indstillingen af genetisk manipulerede modeller vil være forpligtet til at specificere mål og resultater.
Anti- og pro-inflammatoriske reaktioner på ketonorganer
Ketose og ketonlegemer modulerer inflammation og immuncellefunktion, men forskellige og endda uoverensstemmende mekanismer er blevet foreslået. Langvarig mangel på næringsstoffer reducerer betændelse (Youm et al., 2015), men den kroniske ketose af type 1-diabetes er en pro-inflammatorisk tilstand (Jain et al., 2002; Kanikarla-Marie og Jain, 2015; Kurepa et al., 2012 ). Mekanisme-baserede signalroller for? OHB i inflammation opstår, fordi mange immunsystemceller, herunder makrofager eller monocytter, i høj grad udtrykker GPR109A. Mens? OHB udviser et overvejende antiinflammatorisk respons (Fu et al., 2014; Gambhir et al., 2012; Rahman et al., 2014; Youm et al., 2015), kan høje koncentrationer af ketonlegemer, især AcAc, muligvis udløse et proinflammatorisk respons (Jain et al., 2002; Kanikarla-Marie og Jain, 2015; Kurepa et al., 2012).
Anti-inflammatoriske roller af GPR109A-ligander i åreforkalkning, fedme, inflammatorisk tarmsygdom, neurologisk sygdom og kræft er blevet gennemgået (Graff et al., 2016). GPR109A-ekspression forstærkes i RPE-celler fra diabetiske modeller, humane diabetespatienter (Gambhir et al., 2012) og i mikroglia under neurodegeneration (Fu et al., 2014). Antiinflammatoriske virkninger af? OHB forstærkes af GPR109A-overekspression i RPE-celler og ophæves ved farmakologisk hæmning eller genetisk knockout af GPR109A (Gambhir et al., 2012). OHB og eksogen nikotinsyre (Taggart et al., 2005), begge giver antiinflammatoriske virkninger i TNF? eller LPS-induceret betændelse ved at nedsætte niveauerne af proinflammatoriske proteiner (iNOS, COX-2) eller secernerede cytokiner (TNFa, IL-1a, IL-6, CCL2 / MCP-1), delvist gennem inhibering af NF -? B-translokation (Fu et al., 2014; Gambhir et al., 2012). ? OHB nedsætter ER-stress og NLRP3-inflammasomet og aktiverer det antioxidative stressrespons (Bae et al., 2016; Youm et al., 2015). I neurodegenerativ inflammation involverer GPR109A-afhængig? OHB-medieret beskyttelse imidlertid ikke inflammatoriske mediatorer som MAPK pathway-signalering (f.eks. ERK, JNK, p38) (Fu et al., 2014), men kan kræve COX-1-afhængig PGD2 produktion (Rahman et al., 2014). Det er spændende, at makrofag GPR109A kræves for at udøve en neurobeskyttende effekt i en iskæmisk slagmodel (Rahman et al., 2014), men evnen hos? OHB til at hæmme NLRP3-inflammatoren i knoglemarvafledte makrofager er GPR109A uafhængig (Youm et al. ., 2015). Selvom de fleste undersøgelser forbinder? OHB med antiinflammatoriske virkninger, kan? OHB være pro-inflammatorisk og øge markører for lipidperoxidering i kalvehepatocytter (Shi et al., 2014). Anti- versus proinflammatoriske virkninger af? OHB kan således afhænge af celletype,? OHB-koncentration, eksponeringsvarighed og tilstedeværelsen eller fraværet af co-modulatorer.
I modsætning til? OHB kan AcAc aktivere proinflammatorisk signalering. Forhøjet AcAc, især med en høj glukosekoncentration, intensiverer endotelcelleskader gennem en NADPH oxidase / oxidativ stressafhængig mekanisme (Kanikarla-Marie og Jain, 2015). Høje AcAc-koncentrationer i navlestrengen hos diabetiske mødre var korreleret med højere proteinoxidationshastighed og MCP-1-koncentration (Kurepa et al., 2012). Høj AcAc hos diabetespatienter var korreleret med TNF? ekspression (Jain et al., 2002) og AcAc, men ikke? OHB, induceret TNF ?, MCP-1-ekspression, ROS-akkumulering og nedsat cAMP-niveau i U937 humane monocytceller (Jain et al., 2002; Kurepa et al. ., 2012).
Ketonkropsafhængige signalfænomener udløses ofte kun med høje ketonkropskoncentrationer (> 5 mM), og i tilfælde af mange undersøgelser, der forbinder ketoner til pro- eller antiinflammatoriske virkninger gennem uklare mekanismer. Desuden, på grund af de modstridende virkninger af? OHB versus AcAc på inflammation, og evnen af AcAc /? OHB-forhold til at påvirke mitokondrie redox potentiale, sammenligner de bedste eksperimenter, der vurderer ketonlegemers roller på cellulære fænotyper, virkningerne af AcAc og? OHB i forskellige forhold og ved varierende kumulative koncentrationer [fx (Saito et al., 2016)]. Endelig kan AcAc kun købes kommercielt som et lithiumsalt eller som en ethylester, der kræver basehydrolyse inden brug. Lithiumkation inducerer uafhængigt signaltransduktionskaskader (Manji et al., 1995), og AcAc-anion er labil. Endelig kan undersøgelser, der anvender racemisk d / l-? OHB, forveksles, da kun d-? OHB-stereoisomeren kan oxideres til AcAc, men d-? OHB og l-? OHB kan hver signalere gennem GPR109A, hæmme NLRP3-inflammatoren, og tjener som lipogene substrater.
Ketonlegemer, Oxidativ Stress og Neuroprotektion
Oxidativ stress er typisk defineret som en tilstand, hvor ROS præsenteres i overskud på grund af overdreven produktion og/eller nedsat eliminering. Antioxidant- og oxidativ stress-dæmpende roller af ketonlegemer er blevet beskrevet bredt både in vitro og in vivo, især i sammenhæng med neurobeskyttelse. Da de fleste neuroner ikke effektivt genererer højenergifosfater fra fedtsyrer - men oxiderer ketonstoffer, når der er mangel på kulhydrater, er neurobeskyttende virkninger af ketonstoffer særligt vigtige (Cahill GF Jr, 2006; Edmond et al., 1987; Yang et al., 1987). I oxidativ stressmodeller tyder BDH1-induktion og SCOT-undertrykkelse på, at ketonlegememetabolisme kan omprogrammeres til at opretholde forskellig cellesignalering, redoxpotentiale eller metaboliske krav (Nagao et al., 2016; Tieu et al., 2003).
Ketonlegemer reducerer graden af cellulær skade, skade, død og lavere apoptose i neuroner og kardiomyocytter (Haces et al., 2008; Maalouf et al., 2007; Nagao et al., 2016; Tieu et al., 2003). Påberåbte mekanismer er varierede og ikke altid lineært relateret til koncentration. Lave millimolære koncentrationer af (d eller l)-?OHB fjerner ROS (hydroxylanion), mens AcAc fjerner adskillige ROS-arter, men kun ved koncentrationer, der overstiger det fysiologiske område (IC50 20-67 mM) (Haces et al., 2008) . Omvendt er en gavnlig indflydelse på elektrontransportkædens redoxpotentiale en mekanisme, der almindeligvis er forbundet med d-OHB. Mens alle tre ketonlegemer (d/l-?OHB og AcAc) reducerede neuronal celledød og ROS-akkumulering udløst af kemisk hæmning af glykolyse, forhindrede kun d-?OHB og AcAc neuronal ATP-nedgang. Omvendt, i en hypoglykæmisk in vivo-model forhindrede (d eller l)-?OHB, men ikke AcAc hippocampus lipidperoxidation (Haces et al., 2008; Maalouf et al., 2007; Marosi et al., 2016; Murphy, 2009 ; Tieu et al., 2003). In vivo undersøgelser af mus fodret med en ketogen diæt (87 % kcal fedt og 13 % protein) udviste neuroanatomisk variation af antioxidantkapacitet (Ziegler et al., 2003), hvor de mest dybtgående ændringer blev observeret i hippocampus med stigning i glutathionperoxidase og total antioxidant kapacitet.
Ketogen diæt, ketonestere (se også Terapeutisk brug af ketogen diæt og eksogene ketonlegemer) eller ?OHB-administration udøver neurobeskyttelse i modeller for iskæmisk slagtilfælde (Rahman et al., 2014); Parkinsons sygdom (Tieu et al., 2003); ilttoksicitetsanfald i centralnervesystemet (D'Agostino et al., 2013); epileptiske spasmer (Yum et al., 2015); mitokondriel encefalomyopati, laktatacidose og slagtilfælde-lignende (MELAS) episoder syndrom (Frey et al., 2016) og Alzheimers sygdom (Cunnane og Crawford, 2003; Yin et al., 2016). Omvendt påviste en nylig rapport histopatologiske beviser for neurodegenerativ progression ved en ketogen diæt i en transgen musemodel af unormal mitokondriel DNA-reparation, på trods af stigninger i mitokondriel biogenese og antioxidantsignaturer (Lauritzen et al., 2016). Andre modstridende rapporter tyder på, at eksponering for høje ketonlegemekoncentrationer fremkalder oxidativt stress. Høje ?OHB- eller AcAc-doser inducerede nitrogenoxidsekretion, lipidperoxidation, reduceret ekspression af SOD, glutathionperoxidase og katalase i kalve-hepatocytter, mens MAPK-pathway-induktionen i rotte-hepatocytter blev tilskrevet AcAc, men ikke ?OHB (Abdelmegeed et al., 2004. ; Shi et al., 2014; Shi et al., 2016).
Samlet set forbinder de fleste rapporter? OHB til dæmpning af oxidativ stress, da administrationen hæmmer ROS / superoxidproduktion, forhindrer lipidperoxidering og proteinoxidation, øger antioxidantproteinniveauer og forbedrer mitokondrie respiration og ATP produktion (Abdelmegeed et al., 2004; Haces et al., 2008; Jain et al., 1998; Jain et al., 2002; Kanikarla-Marie and Jain, 2015; Maalouf et al., 2007; Maalouf and Rho, 2008; Marosi et al., 2016; Tieu et al., 2003; Yin et al., 2016; Ziegler et al., 2003). Mens AcAc er blevet mere direkte korreleret end? OHB med induktion af oxidativt stress, dissekeres disse effekter ikke altid let fra potentielle proinflammatoriske reaktioner (Jain et al., 2002; Kanikarla-Marie og Jain, 2015; Kanikarla-Marie og Jain, 2016). Desuden er det kritisk at overveje, at den tilsyneladende antioxidative fordel, der tilvejebringes af pleiotropiske ketogene diæter, muligvis ikke transduceres af ketonlegemer i sig selv, og neurobeskyttelse, der tildeles af ketonlegemer, muligvis ikke helt kan tilskrives oxidativ stress. For eksempel under glukosemangel, i en model af glukosmangel i kortikale neuroner, stimulerede? OHB autofagisk flux og forhindrede akkumulering af autophagosom, som var forbundet med nedsat neuronal død (Camberos-Luna et al., 2016). d-? OHB inducerer også de kanoniske antioxidantproteiner FOXO3a, SOD, MnSOD og katalase, prospektivt gennem HDAC-inhibering (Nagao et al., 2016; Shimazu et al., 2013).
Ikke-alkoholisk fedtsyge-sygdom (NAFLD) og ketonlegemetabolisme
Fedme-associeret NAFLD og ikke-alkoholisk steatohepatitis (NASH) er de mest almindelige årsager til leversygdom i vestlige lande (Rinella og Sanyal, 2016), og NASH-induceret leversvigt er en af de mest almindelige årsager til levertransplantation. Mens overskydende opbevaring af triacylglyceroler i hepatocytter> 5% af levervægt (NAFL) alene ikke forårsager degenerativ leverfunktion, korrelerer progressionen til NAFLD hos mennesker med systemisk insulinresistens og øget risiko for type 2-diabetes og kan bidrage til patogenesen af hjerte-kar-sygdom og kronisk nyresygdom (Fabbrini et al., 2009; Targher et al., 2010; Targher og Byrne, 2013). De patogene mekanismer i NAFLD og NASH er ufuldstændigt forstået, men inkluderer abnormiteter i hepatocytmetabolisme, hepatocyt-autofagi og endoplasmatisk retikulumstress, leverimmun cellefunktion, fedtvævbetændelse og systemiske inflammatoriske mediatorer (Fabbrini et al., 2009; Masuoka og Chalasani, 2013 ; Targher et al., 2010; Yang et al., 2010). Forstyrrelser af kulhydrat-, lipid- og aminosyremetabolisme forekommer i og bidrager til fedme, diabetes og NAFLD hos mennesker og i modelorganismer [gennemgået i (Farese et al., 2012; Lin og Accili, 2011; Newgard, 2012; Samuel og Shulman, 2012; Sun og Lazar, 2013)]. Mens hepatocytabnormiteter i cytoplasmatisk lipidmetabolisme ofte observeres i NAFLD (Fabbrini et al., 2010b), er rollen som mitokondrie-metabolisme, som styrer oxidativ bortskaffelse af fedt, mindre klar i NAFLD-patogenesen. Abnormaliteter af mitokondrie metabolisme forekommer i og bidrager til NAFLD / NASH patogenese (Hyotylainen et al., 2016; Serviddio et al., 2011; Serviddio et al., 2008; Wei et al., 2008). Der er generelle (Felig et al., 1974; Iozzo et al., 2010; Koliaki et al., 2015; Satapati et al., 2015; Satapati et al., 2012; Sunny et al., 2011) men ikke ensartede ( Koliaki og Roden, 2013; Perry et al., 2016; Rector et al., 2010) enighed om, at før udviklingen af bona fide NASH, lever mitokondrieoxidation og især fedtoxidation øges i fedme, systemisk insulinresistens og NAFLD. Det er sandsynligt, at efterhånden som NAFLD skrider frem, kommer oxidativ kapacitet heterogenitet, selv blandt individuelle mitokondrier, og i sidste ende bliver oxidativ funktion svækket (Koliaki et al., 2015; Rector et al., 2010; Satapati et al., 2008; Satapati et al. ., 2012).
Ketogenese bruges ofte som en proxy for hepatisk fedtoxidation. Forringelser af ketogenese dukker op, efterhånden som NAFLD skrider frem i dyremodeller og sandsynligvis hos mennesker. Gennem ufuldstændigt definerede mekanismer undertrykker hyperinsulinemi ketogenese, hvilket muligvis bidrager til hypoketonemi sammenlignet med magre kontroller (Bergman et al., 2007; Bickerton et al., 2008; Satapati et al., 2012; Soeters et al., Sunny et al., 2009; , 2011; Vice et al., 2005). Ikke desto mindre er evnen til at cirkulere ketonlegemekoncentrationer til at forudsige NAFLD kontroversiel (M�nnist� et al., 2015; Sanyal et al., 2001). Robuste kvantitative magnetiske resonansspektroskopiske metoder i dyremodeller afslørede øget ketonomsætningshastighed med moderat insulinresistens, men faldende hastigheder var tydelige med mere alvorlig insulinresistens (Satapati et al., 2012; Sunny et al., 2010). Hos overvægtige mennesker med fedtlever er den ketogene hastighed normal (Bickerton et al., 2008; Sunny et al., 2011), og derfor er ketogenesehastigheden formindsket i forhold til den øgede fedtsyrebelastning i hepatocytter. Som følge heraf kan a-oxidationsafledt acetyl-CoA være rettet mod terminal oxidation i TCA-cyklussen, hvilket øger terminal oxidation, phosphoenolpyruvat-drevet gluconeogenese via anaplerose/kataplerose og oxidativt stress. Acetyl-CoA undergår muligvis også eksport fra mitokondrier som citrat, et forløbersubstrat for lipogenese (Fig. 4) (Satapati et al., 2015; Satapati et al., 2012; Solinas et al., 2015). Mens ketogenese bliver mindre følsom over for insulin eller faste med langvarig fedme (Satapati et al., 2012), forbliver de underliggende mekanismer og nedstrøms konsekvenser af dette ufuldstændigt forstået. Nylige beviser indikerer, at mTORC1 undertrykker ketogenese på en måde, der kan være nedstrøms for insulinsignalering (Kucejova et al., 2016), hvilket er i overensstemmelse med observationerne om, at mTORC1 hæmmer PPAR?-medieret Hmgcs2-induktion (Sengupta et al., 2010) ( se også Regulering af HMGCS2 og SCOT/OXCT1).

Foreløbige observationer fra vores gruppe tyder på negative leverkonsekvenser af ketogen insufficiens (Cotter et al., 2014). For at teste hypotesen om, at svækket ketogenese, selv i kulhydratfyldte og dermed "ikke-ketogene" tilstande, bidrager til unormal glukosemetabolisme og fremkalder steatohepatitis, genererede vi en musemodel af markant ketogen insufficiens ved administration af antisense oligonukleotider målrettede (AS) Hmgcs2. Tab af HMGCS2 i almindelige, fedtfattige chow-fodrede voksne mus forårsagede mild hyperglykæmi og markant øget produktion af hundredvis af levermetabolitter, hvoraf en række kraftigt antydede aktivering af lipogenese. Fodring med højt fedtindhold af mus med utilstrækkelig ketogenese resulterede i omfattende hepatocytskade og betændelse. Disse resultater understøtter de centrale hypoteser om, at (i) ketogenese ikke er en passiv overløbsvej, men snarere en dynamisk knude i hepatisk og integreret fysiologisk homeostase, og (ii) forsigtig ketogen forstærkning for at afbøde NAFLD/NASH og forstyrret leverglukosemetabolisme er værd at udforske .
Hvordan kan nedsat ketogenese bidrage til leverskade og ændret glukosehomeostase? Den første overvejelse er, om synderen er mangel på ketogen flux eller ketoner i sig selv. En nylig rapport antyder, at ketonlegemer kan afbøde oxidativ stressinduceret leverskade som reaktion på n-3 flerumættede fedtsyrer (Pawlak et al., 2015). Husk på, at ketonlegemer ikke oxideres på grund af mangel på SCOT-ekspression i hepatocytter, men de kan bidrage til lipogenese og tjene en række signaleringsroller uafhængigt af deres oxidation (se også ikke-oxidative metaboliske skæbne til ketonlegemer og? OHB som en signalformidler). Det er også muligt, at ketonlegemer, der er afledt af hepatocytter, kan tjene som et signal og / eller metabolit for nærliggende celletyper i den hepatiske acinus, herunder stjerneceller og Kupffer-cellemakrofager. Mens den begrænsede tilgængelige litteratur antyder, at makrofager ikke er i stand til at oxidere ketonlegemer, er dette kun blevet målt ved hjælp af klassiske metoder og kun i peritoneale makrofager (Newsholme et al., 1986; Newsholme et al., 1987), hvilket indikerer, at en vurdering er passende givet rigelig SCOT-ekspression i knoglemarvafledte makrofager (Youm et al., 2015).
Hepatocyt ketogen flux kan også være cytobeskyttende. Mens de sundhedsmæssige mekanismer muligvis ikke afhænger af ketogenese i sig selv, er ketogene diæter med lavt kulhydratindhold blevet forbundet med forbedring af NAFLD (Browning et al., 2011; Foster et al., 2010; Kani et al., 2014; Schugar og Crawford, 2012) . Vores observationer indikerer, at hepatocyt-ketogenese kan give feedback og regulere TCA-cyklusflux, anaplerotisk flux, phosphoenolpyruvat-afledt gluconeogenese (Cotter et al., 2014) og endda glykogenomsætning. Ketogen svækkelse leder acetyl-CoA til at øge TCA-flux, som i leveren er blevet forbundet med øget ROS-medieret skade (Satapati et al., 2015; Satapati et al., 2012); tvinger omledning af kulstof til de novo syntetiserede lipidarter, der kunne vise sig at være cytotoksiske; og forhindrer NADH re-oxidation til NAD+ (Cotter et al., 2014) (fig. 4). Samlet set er fremtidige eksperimenter nødvendige for at adressere mekanismer, hvorigennem relativ ketogen insufficiens kan blive maladaptiv, bidrage til hyperglykæmi, fremkalde steatohepatitis, og om disse mekanismer er operante i human NAFLD/NASH. Da epidemiologiske beviser tyder på nedsat ketogenese under progressionen af steatohepatitis (Embade et al., 2016; Marinou et al., 2011; M�nnist� et al., 2015; Pramfalk et al., 2015; Safaei et al.), 2016. terapier, der øger hepatisk ketogenese, kan vise sig at være gavnlige (Degirolamo et al., 2016; Honda et al., 2016).
Ketonlegemer og hjertesvigt (HF)
Med en metabolisk hastighed på over 400 kcal/kg/dag og en omsætning på 6-35 kg ATP/dag er hjertet det organ med det højeste energiforbrug og det højeste oxidative behov (Ashrafian et al., 2007; Wang et al., 2010b). Langt størstedelen af myokardiets energiomsætning ligger inden for mitokondrier, og 70% af denne forsyning stammer fra FAO. Hjertet er altædende og fleksibelt under normale forhold, men det patologisk omdannende hjerte (f.eks. på grund af hypertension eller myokardieinfarkt) og det diabetiske hjerte bliver hver især metabolisk ufleksible (Balasse og Fery, 1989; BING, 1954; Fukao et al., 2004 ; Lopaschuk et al., 2010; Taegtmeyer et al., 1980; Taegtmeyer et al., 2002; Young et al., 2002). Faktisk fremkalder genetisk programmerede abnormiteter af hjertebrændstofmetabolisme i musemodeller kardiomyopati (Carley et al., 2014; Neubauer, 2007). Under fysiologiske forhold oxiderer normale hjerter ketonlegemer i forhold til deres levering på bekostning af fedtsyre- og glucoseoxidation, og myokardium er den højeste ketonlegemeforbruger pr. masseenhed (BING, 1954; Crawford et al., 2009; GARLAND et al. ., 1962; Hasselbaink et al., 2003; Jeffrey et al., 1995; Pelletier et al., 2007; Tardif et al., 2001; Yan et al., 2009). Sammenlignet med fedtsyreoxidation er ketonstoffer mere energieffektive, hvilket giver mere energi tilgængelig til ATP-syntese pr. molekyle investeret ilt (P/O-forhold) (Kashiwaya et al., 2010; Sato et al., 1995; Veech, 2004) . Ketonlegemeoxidation giver også potentielt højere energi end FAO, hvilket holder ubiquinon oxideret, hvilket øger redoxspændvidden i elektrontransportkæden og gør mere energi tilgængelig til at syntetisere ATP (Sato et al., 1995; Veech, 2004). Oxidation af ketonstoffer kan også begrænse ROS-produktionen og dermed oxidativt stress (Veech, 2004).
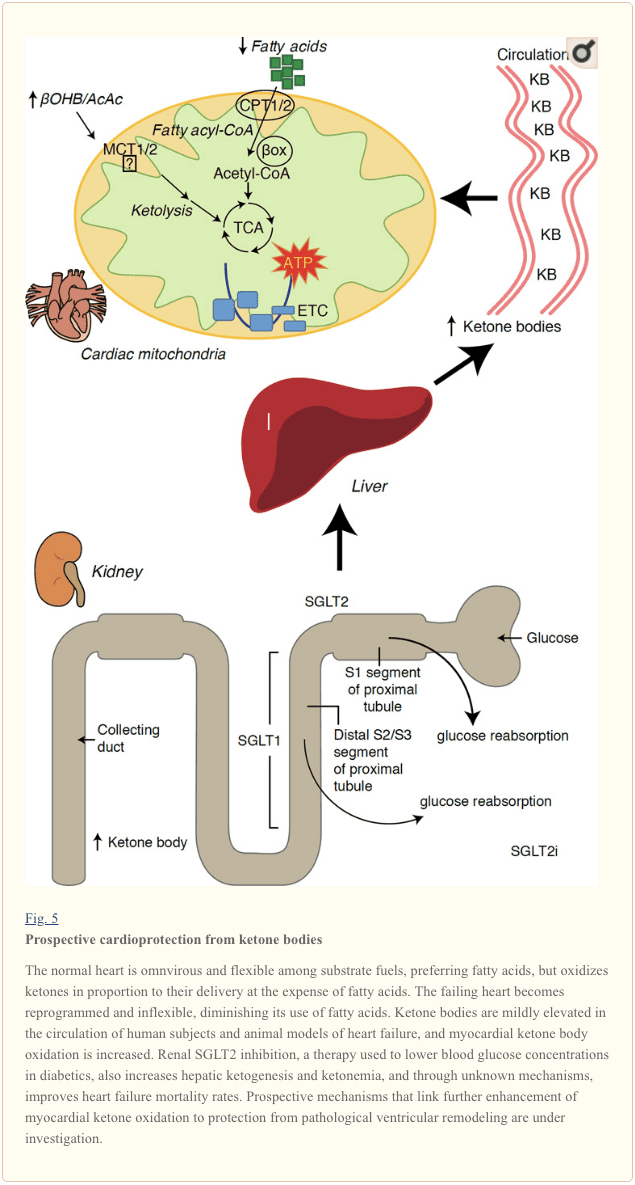
Preliminære interventions- og observationsstudier indikerer en potentiel velgørende rolle af ketonlegemer i hjertet. I den eksperimentelle iskæmi / reperfusionsskadesammensætning tillod ketonlegemer potentielle kardioprotektive virkninger (Al-Zaid et al., 2007; Wang et al., 2008), muligvis på grund af øget mitokondriell overflod i hjertet eller opregulering af afgørende oxidativ phosphorylering mediatorer (Snorek et al., 2012; Zou et al., 2002). Nylige undersøgelser indikerer, at ketonkroppens udnyttelse er forøget i manglende hjerter hos mus (Aubert et al., 2016) og mennesker (Bedi et al., 2016), der støtter forudgående observationer hos mennesker (BING, 1954; Fukao et al., 2000; Janardhan et al., 2011; Longo et al., 2004; Rudolph og Schinz, 1973; Tildon og Cornblath, 1972). Kropskoncentrationer i cirkulerende keton øges hos patienter med hjertesvigt, i direkte forhold til påfyldningstryk, observationer hvis mekanisme og betydning forbliver ukendt (Kupari et al., 1995; Lommi et al., 1996; Lommi et al., 1997; Neely et al. ., 1972), men mus med selektiv SCOT-mangel i cardiomyocytter udviser accelereret patologisk ventrikulær remodeling og ROS-signaturer som svar på kirurgisk induceret trykoverbelastningsskade (Schugar et al., 2014).
Nyligt spændende observationer i diabetesbehandling har vist en potentiel sammenhæng mellem myokardisk ketonmetabolisme og patologisk ventrikulær remodeling (figur 5). Inhibering af den renale proximale tubulære natrium / glucose-co-transportør 2 (SGLT2i) øger koncentrationen af ketonkroppen i mennesker (Ferrannini et al., 2016a; Inagaki et al., 2015) og mus (Suzuki et al., 2014) via øget hepatisk ketogenese (Ferrannini et al., 2014, Ferrannini et al., 2016a; Katz og Leiter, 2015; Mudaliar et al., 2015). Påfaldende faldt mindst en af disse stoffer HF-hospitalisering (fx som afsløret af EMPA-REG OUTCOME-forsøg) og forbedret kardiovaskulær dødelighed (Fitchett et al., 2016; Sonesson et al., 2016; Wu et al., 2016a Zinman et al., 2015). Selvom førermekanismerne bag positive HF-resultater til forbundne SGLT2i forbliver aktivt debatteret, er overlevelsesfordelen sandsynligvis multifaktorial, fremadrettet inklusiv ketosis, men også salutære virkninger på vægt-, blodtryk-, glukose- og urinsyre niveauer, arteriel stivhed, sympatisk nervesystem, osmotisk diurese / reduceret plasmavolumen og øget hæmatokrit (Raz og Cahn, 2016, Vallon og Thomson, 2016). Tværtimod forbliver tanken om, at terapeutisk stigende ketonæmi enten hos HF-patienter eller dem med høj risiko for at udvikle HF, kontroversiel, men er under aktiv undersøgelse i prækliniske og kliniske studier (Ferrannini et al., 2016b; Kolwicz et al., 2016; Lopaschuk og Verma, 2016; Mudaliar et al., 2016; Taegtmeyer, 2016).
Ketonlegemer i kræftbiologi
Forbindelser mellem ketonlegemer og kræft udvikler sig hurtigt, men studier i både dyremodeller og mennesker har givet forskellige konklusioner. Fordi ketonmetabolisme er dynamisk og næringsstoftilstand, er det lokkende at forfølge biologiske forbindelser til kræft på grund af muligheden for præcisionsstyrede ernæringsmæssige terapier. Kræftceller undergår metabolisk omprogrammering for at opretholde hurtig celleproliferation og vækst (DeNicola og Cantley, 2015; Pavlova og Thompson, 2016). Den klassiske Warburg-effekt i kræftcellemetabolismen stammer fra den dominerende rolle glykolyse og mælkesyrefermentation for at overføre energi og kompensere for lavere afhængighed af oxidativ phosphorylering og begrænset mitokondriell respiration (De Feyter et al., 2016; Grabacka et al., 2016; Kang et al., 2015; Poff et al., 2014; Shukla et al., 2014). Glucosecarbon er primært rettet gennem glycolyse, pentosephosphatvejen og lipogenese, som tilsammen tilvejebringer mellemprodukter, der er nødvendige for ekspansion af tumorbiomasse (Grabacka et al., 2016; Shukla et al., 2014; Yoshii et al., 2015). Tilpasning af kræftceller til glukoseafrivning sker gennem evnen til at udnytte alternative brændstofkilder, herunder acetat, glutamin og aspartat (Jaworski et al., 2016; Sullivan et al., 2015). For eksempel afslører begrænset adgang til pyruvat cancercellernes evne til at omdanne glutamin til acetyl-CoA ved carboxylering og opretholde både energetiske og anabolske behov (Yang et al., 2014). En interessant tilpasning af cancerceller er anvendelsen af acetat som et brændstof (Comerford et al., 2014; Jaworski et al., 2016; Mashimo et al., 2014; Wright og Simone, 2016; Yoshii et al., 2015). Acetat er også et substrat for lipogenese, hvilket er kritisk for tumorcelleproliferation, og forstærkning af denne lipogene kanal er forbundet med kortere patientoverlevelse og større tumorbyrde (Comerford et al., 2014; Mashimo et al., 2014; Yoshii et al. ., 2015).
Ikke-kræftceller skifter nemt deres energikilde fra glukose til ketonlegemer under glukosemangel. Denne plasticitet kan være mere variabel blandt kræftcelletyper, men in vivo implanterede hjernetumorer oxiderede [2,4-13C2]-?OHB i samme grad som omgivende hjernevæv (De Feyter et al., 2016). �Omvendt Warburg-effekt� eller �to-kompartment tumormetabolisme�-modeller antager, at cancerceller inducerer OHB-produktion i tilstødende fibroblaster, der leverer tumorcellens energibehov (Bonuccelli et al., 2010; Martinez-Outschoorn et al.), 2012. . I leveren er et skift i hepatocytter fra ketogenese til ketonoxidation i hepatocellulære carcinomceller (hepatom) i overensstemmelse med aktivering af BDH1- og SCOT-aktiviteter observeret i to hepatomcellelinjer (Zhang et al., 1989). Faktisk udtrykker hepatomceller OXCT1 og BDH1 og oxiderer ketoner, men kun når serum sultede (Huang et al., 2016). Alternativt er tumorcelleketogenese også blevet foreslået. Dynamiske skift i ketogen genekspression er udstillet under cancerøs transformation af tyktarmsepitel, en celletype, der normalt udtrykker HMGCS2, og en nylig rapport antydede, at HMGCS2 kan være en prognostisk markør for dårlig prognose i kolorektale og pladecellekarcinomer (Camarero et al., 2006; Chen et al., 2016). Hvorvidt denne forening kræver eller involverer ketogenese eller en måneskinsfunktion af HMGCS2, skal stadig afgøres. Omvendt, tilsyneladende ?OHB-produktion af melanom- og glioblastomceller, stimuleret af PPAR? agonist fenofibrat, var forbundet med vækststop (Grabacka et al., 2016). Yderligere undersøgelser er nødvendige for at karakterisere rollerne af HMGCS2/SCOT-ekspression, ketogenese og ketonoxidation i cancerceller.
Ud over brændstofmetabolismens område er ketoner for nylig blevet impliceret i kræftcellebiologi via en signalmekanisme. Analyse af BRAF-V600E + melanom indikerede OCT1-afhængig induktion af HMGCL på en onkogen BRAF-afhængig måde (Kang et al., 2015). HMGCL-forstærkning blev korreleret med højere cellulær AcAc-koncentration, hvilket igen forbedrede BRAFV600E-MEK1-interaktion, hvilket forstærkede MEK-ERK-signalering i en feed-forward-loop, der driver tumorcelleproliferation og -vækst. Disse observationer rejser det spændende spørgsmål om potentiel ekstrahepatisk ketogenese, der derefter understøtter en signalmekanisme (se også OHB som en signalmægler og kontroverser i ekstrahepatisk ketogenese). Det er også vigtigt at overveje uafhængige virkninger af AcAc, d-? OHB og l-? OHB på kræftmetabolisme, og når man overvejer HMGCL, kan leucinkatabolisme også blive forstyrret.
Effekterne af ketogene diæter (se også Terapeutisk brug af ketogen diæt og eksogene ketonstoffer) i cancerdyremodeller er varierede (De Feyter et al., 2016; Klement et al., 2016; Meidenbauer et al., 2015; Poff et al. ., 2014; Seyfried et al., 2011; Shukla et al., 2014). Mens epidemiologiske sammenhænge mellem fedme, kræft og ketogene diæter diskuteres (Liskiewicz et al., 2016; Wright og Simone, 2016), antydede en metaanalyse, der anvender ketogene diæter i dyremodeller og i menneskelige undersøgelser, en gavnlig indvirkning på overlevelse, med fordele prospektivt forbundet med størrelsen af ketose, tidspunktet for diætstart og tumorplacering (Klement et al., 2016; Woolf et al., 2016). Behandling af bugspytkirtelkræftceller med ketonstoffer (d-?OHB eller AcAc) hæmmede vækst, proliferation og glykolyse, og en ketogen diæt (81 % kcal fedt, 18 % protein, 1 % kulhydrat) reducerede in vivo tumorvægt, glykæmi og øget muskel- og kropsvægt hos dyr med implanteret cancer (Shukla et al., 2014). Lignende resultater blev observeret ved brug af en metastatisk glioblastomcellemodel i mus, der modtog ketontilskud i kosten (Poff et al., 2014). Omvendt øgede en ketogen diæt (91 % kcal fedt, 9 % protein) den cirkulerende "OHB-koncentration og formindsket glykæmi", men havde ingen indflydelse på hverken tumorvolumen eller overlevelsesvarighed hos gliombærende rotter (De Feyter et al., 2016). Et glukoseketonindeks er blevet foreslået som en klinisk indikator, der forbedrer metabolisk styring af ketogen diæt-induceret hjernekræftbehandling hos mennesker og mus (Meidenbauer et al., 2015). Samlet set er rollerne af ketonlegememetabolisme og ketonlegemer i cancerbiologi fristende, fordi de hver især udgør håndterbare terapeutiske muligheder, men grundlæggende aspekter mangler at blive belyst, med klare påvirkninger, der kommer fra en matrix af variabler, herunder (i) forskelle mellem eksogen keton legemer versus ketogen diæt, (ii) cancercelletype, genomiske polymorfismer, grad og stadie; og (iii) timing og varighed af eksponering for den ketotiske tilstand.

Ketogenese skabes af ketonlegemer gennem nedbrydning af fedtsyrer og ketogene aminosyrer. Denne biokemiske proces giver energi til forskellige organer, specielt hjernen, under faste forhold som et svar på en utilgængelighed af blodglukose. Ketonlegemer produceres hovedsageligt i mitokondrier af leverceller. Mens andre celler er i stand til at udføre ketogenese, er de ikke så effektive til at gøre det som leverceller. Fordi ketogenese forekommer i mitokondrier, reguleres dets processer uafhængigt. Dr. Alex Jimenez DC, CCST Insight
Terapeutisk anvendelse af Ketogenic Diet og Exogenous Ketone Bodies
Anvendelsen af ketogen diæt og ketonstoffer som terapeutiske redskaber er også opstået i ikke-cancerøse sammenhænge, herunder fedme og NAFLD/NASH (Browning et al., 2011; Foster et al., 2010; Schugar og Crawford, 2012); hjertesvigt (Huynh, 2016; Kolwicz et al., 2016; Taegtmeyer, 2016); neurologisk og neurodegenerativ sygdom (Martin et al., 2016; McNally og Hartman, 2012; Rho, 2015; Rogawski et al., 2016; Yang og Cheng, 2010; Yao et al., 2011); medfødte metabolismefejl (Scholl-Burgi et al, 2015); og træningspræstation (Cox et al., 2016). Effektiviteten af ketogen diæt er især blevet værdsat i terapi af epileptiske anfald, især hos lægemiddelresistente patienter. De fleste undersøgelser har evalueret ketogen diæt hos pædiatriske patienter og afslører op til en ~50% reduktion i anfaldshyppighed efter 3 måneder, med forbedret effektivitet i udvalgte syndromer (Wu et al., 2016b). Erfaringen er mere begrænset i voksen epilepsi, men en lignende reduktion er tydelig, med bedre respons hos symptomatisk generaliseret epilepsi patienter (Nei et al., 2014). De underliggende anti-konvulsive mekanismer forbliver uklare, selvom postulerede hypoteser omfatter reduceret glukoseudnyttelse/glykolyse, omprogrammeret glutamattransport, indirekte påvirkning af ATP-følsom kaliumkanal eller adenosin A1-receptor, ændring af natriumkanalisoform-ekspression eller effekter på cirkulerende hormoner inklusive leptin ( Lambrechts et al., 2016; Lin et al., 2017; Lutas og Yellen, 2013). Det er fortsat uklart, om den anti-konvulsive effekt primært kan tilskrives ketonstoffer eller på grund af de kaskade metaboliske konsekvenser af diæter med lavt kulhydratindhold. Ikke desto mindre synes ketonestere (se nedenfor) at hæve anfaldstærsklen i dyremodeller af fremkaldte anfald (Ciarlone et al., 2016; D'Agostino et al., 2013; Viggiano et al., 2015).
Atkins-stil og ketogen, lavt kulhydrat kostvaner anses ofte for ubehagelige og kan forårsage forstoppelse, hyperuricæmi, hypokalcæmi, hypomagnesæmi, føre til nefrolithiasis, ketoacidose, forårsage hyperglykæmi og øge koncentrationen af cirkulerende cholesterol og fri fedtsyre (Bisschop et al., 2001 Kossoff og Hartman, 2012; Kwiterovich et al., 2003; Suzuki et al., 2002). Af disse årsager udgør langsigtet adherence udfordringer. Gnagereundersøgelser bruger almindeligvis en særskilt makronæringsfordeling (94% kcalfedt, 1% kcal carbohydrat, 5% kcal protein, Bio-Serv F3666), hvilket fremkalder en robust ketose. Imidlertid øger proteinindholdet selv til 10% kcal væsentligt ketosis, og 5% kcal proteinrestriktion tillader konfronterende metaboliske og fysiologiske virkninger. Denne diætformulering er også cholinudarmet, en anden variabel, som påvirker følsomheden over for leverskader og endog ketogenese (Garbow et al., 2011; Jornayvaz et al., 2010; Kennedy et al., 2007; Pissios et al., 2013; Schugar et al., 2013). Virkninger af langvarigt forbrug af ketogene diæter hos mus forbliver ufuldstændigt defineret, men nyere undersøgelser hos mus afslørede normal overlevelse og fraværet af leverskademarkører hos mus på ketogene diæter i løbet af deres levetid, selv om aminosyremetabolisme, energiforbrug og insulinsignalering blev markant omprogrammeret (Douris et al., 2015).
Mekanismer, der øger ketosis gennem mekanismer, der er alternative til ketogene kostvaner, indbefatter anvendelsen af indtagelige ketonlegemer. Administrering af eksogene ketonlegemer kan skabe en unik fysiologisk tilstand, der ikke opstår i normal fysiologi, fordi cirkulerende glukose- og insulinkoncentrationer er relativt normale, mens cellerne kan spare glucoseoptagelse og -udnyttelse. Ketonlegemer har selv korte halveringstider, og indtagelse eller infusion af natrium-OHB-salt for at opnå terapeutisk ketose fremkalder en uheldig natriumbelastning. R / S-1,3-butandiol er en ikke-toksisk dialkohol, der let oxideres i leveren til opnåelse af d / l- OHB (Desrochers et al., 1992). I forskellige eksperimentelle sammenhænge er denne dosis administreret dagligt til mus eller rotter i så længe som syv uger, hvilket giver cirkulerende? OHB-koncentrationer på op til 5 mM inden for 2 timer efter administration, hvilket er stabilt i mindst yderligere 3 timer (D ' Agostino et al., 2013). Delvis undertrykkelse af fødeindtaget er blevet observeret hos gnavere givet R / S-1,3-butandiol (Carpenter og Grossman, 1983). Derudover er tre kemisk adskilte ketonestere (KE'er), (i) monoester af R-1,3-butandiol og d-aOHB (R-3-hydroxybutylR-? OHB); (ii) glyceryl-tris-? OHB; og (iii) R, S-1,3-butandiolacetoacetat-diester, er også blevet grundigt undersøgt (Brunengraber, 1997; Clarke et al., 2012a; Clarke et al., 2012b; Desrochers et al., 1995a; Desrochers et al. ., 1995b; Kashiwaya et al., 2010). En iboende fordel ved førstnævnte er, at der produceres 2 mol fysiologisk d-? OHB pr. Mol KE efter esterasehydrolyse i tarmen eller leveren. Sikkerhed, farmakokinetik og tolerance er blevet undersøgt mest omfattende hos mennesker, der indtager R-3-hydroxybutyl R-? OHB, ved doser op til 714 mg / kg, hvilket giver cirkulerende d-? OHB-koncentrationer op til 6 mM (Clarke et al., 2012a; Cox et al., 2016; Kemper et al., 2015; Shivva et al., 2016). Hos gnavere nedsætter denne KE kalorindtag og plasma totalt kolesterol, stimulerer brun fedtvæv og forbedrer insulinresistens (Kashiwaya et al., 2010, Kemper et al., 2015; Veech, 2013). Nylige fund indikerer, at R-3-hydroxybutyl R-? OHB-indtagelse under træning hos trænede atleter nedsatte skeletmuskelglykolyse og plasmalactatkoncentrationer, øget intramuskulær triacylglyceroloxidation og bevaret muskelglykogenindhold, selv når co-indtaget kulhydrat stimuleret insulinsekretion ( Cox et al., 2016). Yderligere udvikling af disse spændende resultater er påkrævet, fordi forbedringen i udholdenhedsøvelsen var overvejende drevet af et robust svar på KE i 2 / 8-emnerne. Ikke desto mindre understøtter disse resultater klassiske undersøgelser, som indikerer en præference for ketonoxidation over andre substrater (GARLAND et al., 1962; Hasselbaink et al., 2003; Stanley et al., 2003; Valente-Silva et al., 2015), herunder under træning, og at uddannede atleter kan være mere primede til at udnytte ketoner (Johnson et al., 1969a; Johnson og Walton, 1972; Winder et al., 1974; Winder et al., 1975). Endelig må de mekanismer, der understøtter forbedret træningsevne efter samme kalorieindtag (differentielt fordelt mellem makronæringsstoffer) og lige iltforbrugstal, bestemmes.
Fremtidsperspektiv
Når først i høj grad var stigmatiseret som en overløbsvej, der er i stand til at akkumulere toksiske emissioner fra fedtforbrænding i kulhydratbegrænsede tilstande (det ketotoksiske paradigme), understøtter nyere observationer forestillingen om, at ketonlegememetabolisme tjener en gavnlig rolle selv i kulhydratfyldte tilstande, hvilket åbner en ketohormetik � hypotese. Mens de lette ernæringsmæssige og farmakologiske tilgange til at manipulere ketonmetabolisme gør det til et attraktivt terapeutisk mål, forbliver aggressivt stillede, men forsigtige eksperimenter i både de grundlæggende og translationelle forskningslaboratorier. Uopfyldte behov er opstået inden for områderne for at definere rollen af at udnytte ketonmetabolisme i hjertesvigt, fedme, NAFLD/NASH, type 2-diabetes og cancer. Omfanget og virkningen af ketonlegemers 'ikke-kanoniske' signaleringsroller, herunder regulering af PTM'er, der sandsynligvis feeds tilbage og fremad i metaboliske og signalveje, kræver dybere udforskning. Endelig kunne ekstrahepatisk ketogenese åbne spændende parakrine og autokrine signalmekanismer og muligheder for at påvirke co-metabolisme i nervesystemet og tumorer for at opnå terapeutiske mål.
Tak
Ncbi.nlm.nih.gov/pmc/articles/PMC5313038/
Fodnoter
Som konklusion er ketonstoffer skabt af leveren for at blive brugt som energikilde, når der ikke er nok glukose let tilgængeligt i menneskekroppen. Ketogenese opstår, når der er lave glukoseniveauer i blodet, især efter at andre cellulære kulhydratlagre er opbrugt. Formålet med artiklen ovenfor var at diskutere de multidimensionelle roller af ketonlegemer i brændstofmetabolisme, signalering og terapi. Omfanget af vores information er begrænset til kiropraktik og rygsøjlesundhedsproblemer. For at diskutere emnet, er du velkommen til at spørge Dr. Jimenez eller kontakte os på�915-850-0900 .
Kurateret af Dr. Alex Jimenez
Henvist til: Ncbi.nlm.nih.gov/pmc/articles/PMC5313038/

Yderligere emnediskussion: Akut rygsmerter
Rygsmerte er en af de mest udbredte årsager til handicap og ubesvarede arbejdsdage over hele verden. Rygsmerter tilskrives den næst hyppigste årsag til lægehjælp, der kun overtales af infektioner i øvre luftveje. Ca. 80 procent af befolkningen vil opleve rygsmerter mindst én gang i hele deres liv. Rygsøjlen er en kompleks struktur, der består af knogler, led, ledbånd og muskler, blandt andet blødt væv. Skader og / eller forværrede forhold, såsom herniated diske, kan i sidste ende føre til symptomer på rygsmerter. Sportsskader eller bilulykkesskader er ofte den hyppigste årsag til rygsmerter, men nogle gange kan de enkleste bevægelser have smertefulde resultater. Heldigvis kan alternative behandlingsmuligheder, såsom kiropraktisk pleje, hjælpe med at lindre rygsmerter gennem brug af spinaljusteringer og manuelle manipulationer, hvilket i sidste ende forbedrer smertelindring. �

EKSTRA EKSTRA | VIGTIGT EMNE: Anbefalet El Paso, TX Kiropraktor
***
Oplysningerne heri om "Ketonlegemers multidimensionelle roller" er ikke beregnet til at erstatte et en-til-en-forhold med en kvalificeret sundhedsperson eller autoriseret læge og er ikke medicinsk rådgivning. Vi opfordrer dig til at træffe sundhedsbeslutninger baseret på din forskning og partnerskab med en kvalificeret sundhedsperson.
Bloginformation og diskussioner om omfang
Vores informationsomfang er begrænset til kiropraktik, muskuloskeletal, fysisk medicin, wellness, bidragende ætiologisk viscerosomatiske forstyrrelser inden for kliniske præsentationer, tilhørende somatovisceral refleks klinisk dynamik, subluksationskomplekser, følsomme helbredsproblemer og/eller funktionel medicin artikler, emner og diskussioner.
Vi giver og præsenterer klinisk samarbejde med specialister fra forskellige discipliner. Hver specialist er styret af deres faglige omfang af praksis og deres licensjurisdiktion. Vi bruger funktionelle sundheds- og velværeprotokoller til at behandle og understøtte pleje af skader eller lidelser i bevægeapparatet.
Vores videoer, indlæg, emner, emner og indsigt dækker kliniske forhold, problemstillinger og emner, der relaterer til og direkte eller indirekte understøtter vores kliniske anvendelsesområde.*
Vores kontor har med rimelighed forsøgt at give støttende citater og har identificeret den eller de relevante forskningsundersøgelser, der understøtter vores indlæg. Vi leverer kopier af understøttende forskningsundersøgelser tilgængelige for tilsynsråd og offentligheden efter anmodning.
Vi forstår, at vi dækker forhold, der kræver yderligere forklaring på, hvordan det kan hjælpe med en bestemt plejeplan eller behandlingsprotokol. derfor er du velkommen til at spørge for yderligere at diskutere emnet ovenfor Dr. Alex Jimenez, DC, eller kontakte os på 915-850-0900.
Vi er her for at hjælpe dig og din familie.
Blessings
Dr. Alex Jimenez A.D. MSACP, RN*, CCST, Ifmcp*, CIFM*, ATN*
Email: coach@elpasofunctionalmedicine.com
Licenseret som Doctor of Chiropractic (DC) i Texas & New Mexico*
Texas DC-licensnummer TX5807, New Mexico DC Licensnr. NM-DC2182
Licenseret som registreret sygeplejerske (RN*) in Florida
Florida-licens RN-licens # RN9617241 (Kontrol nr. 3558029)
Kompakt status: Multi-State Licens: Bemyndiget til at praktisere i 40 stater*
Dr. Alex Jimenez DC, MSACP, RN*CIFM*, IFMCP*, ATN*, CCST
Mit digitale visitkort