Blekekemi:Alle smertesyndromer har en betændelsesprofil. En inflammatorisk profil kan variere fra person til person og kan også variere i en person på forskellige tidspunkter. Behandling af smertesyndrom er at forstå denne betændelsesprofil. Smertsyndrom behandles medicinsk, kirurgisk eller begge dele. Målet er at hæmme / undertrykke produktionen af inflammatoriske mediatorer. Og et vellykket resultat er et resultat, der resulterer i mindre betændelse og selvfølgelig mindre smerte.
Indhold
Biokemi af smerte
mål:
- Hvem er nøgleaktørerne
- Hvad er de biokemiske mekanismer?
- Hvad er konsekvenserne?
Inflammation anmeldelse:
centrale aktører
 Hvorfor gør min skulder ondt? En gennemgang af det neuroanatomiske og biokemiske grundlag for skuldersmerter
Hvorfor gør min skulder ondt? En gennemgang af det neuroanatomiske og biokemiske grundlag for skuldersmerter
ABSTRACT
Hvis en patient spørger `` hvorfor gør min skulder ondt? '' Vil samtalen hurtigt henvende sig til videnskabelig teori og undertiden ubegrundet formodning. Ofte bliver klinikeren opmærksom på grænserne for det videnskabelige grundlag for deres forklaring og viser, at vores forståelse af arten af skuldersmerter er ufuldstændig. Denne gennemgang tager en systematisk tilgang til at hjælpe med at besvare grundlæggende spørgsmål vedrørende skulderpine med henblik på at give indsigt i fremtidig forskning og nye metoder til behandling af skulderpine. Vi skal undersøge roller (1) de perifere receptorer, (2) perifer smertebehandling eller nociception , (3) rygmarven, (4) hjernen, (5) placeringen af receptorer i skulderen og (6) ) skulderens neurale anatomi. Vi overvejer også, hvordan disse faktorer kan bidrage til variationen i den kliniske præsentation, diagnosen og behandlingen af skuldersmerter. På denne måde tilstræber vi at give et overblik over komponenterne i det perifere smertepåvisningssystem og centrale smertebehandlingsmekanismer i skuldersmerter, der interagerer for at producere klinisk smerte.
INDLEDNING: EN MEGET KORT HISTORIE AF PINE SCIENCE ESSENTIAL FOR CLINICIANS
Arten af smerte har generelt været genstand for meget kontrovers i løbet af det sidste århundrede. I det 17. århundrede foreslog Descartes teori1, at smerteintensiteten var direkte relateret til mængden af tilknyttet vævsskade, og at smerter blev behandlet på en adskilt vej. Mange tidligere teorier påberåbte sig denne såkaldte dualist Descartianske filosofi, idet de så smerte som en konsekvens af stimuleringen af en specifik perifer smertereceptor i hjernen. I det 20. århundrede fulgte en videnskabelig kamp mellem to modsatte teorier, nemlig specificitetsteori og mønsterteori. Descartian specificitetsteorien ́ så smerte som en specifik separat modalitet af sensorisk input med sit eget apparat, mens mønsterteori følte at smerte skyldtes den intense stimulering af ikke-specifikke receptorer.2 I 1965 Wall og Melzack 3 gate teori om smerte gav bevis for en model, hvor smerteopfattelse blev moduleret af både sensorisk feedback og centralnervesystemet. Et andet stort fremskridt inden for smerte teori omkring samme tid oplevede opdagelsen af opioidernes specifikke virkningsmåde.4 Derefter har de seneste fremskridt inden for neuroimaging og molekylær medicin i vid udstrækning udvidet vores samlede forståelse af smerte.
Så hvordan hænger dette sammen med skuldersmerter?�Skulder smerter er et almindeligt klinisk problem, og en robust forståelse af den måde, hvorpå smerter behandles af kroppen, er afgørende for bedst at diagnosticere og behandle en patients smerte. Fremskridt i vores viden om smertebehandling lover at forklare uoverensstemmelsen mellem patologi og opfattelsen af smerte, de kan også hjælpe os med at forklare, hvorfor visse patienter ikke reagerer på visse behandlinger.
GRUNDLÆGGENDE BLOKER AF PAIN
Perifere sensoriske receptorer: mekanoreceptoren og nociceptoren
Der er adskillige typer af perifere sensoriske receptorer til stede i det humane muskuloskeletale system. 5 De kan klassificeres ud fra deres funktion (som mekanoreceptorer, termoreceptorer eller nociceptorer) eller morfologi (frie nerveender eller forskellige typer indkapslede receptorer) .5 De forskellige typer receptorer kan derefter yderligere underklasseres baseret på tilstedeværelsen af visse kemiske markører. Der er f.eks. Signifikante overlapninger mellem forskellige funktionelle receptorklasser
Behandling af perifere smerter: Nociception
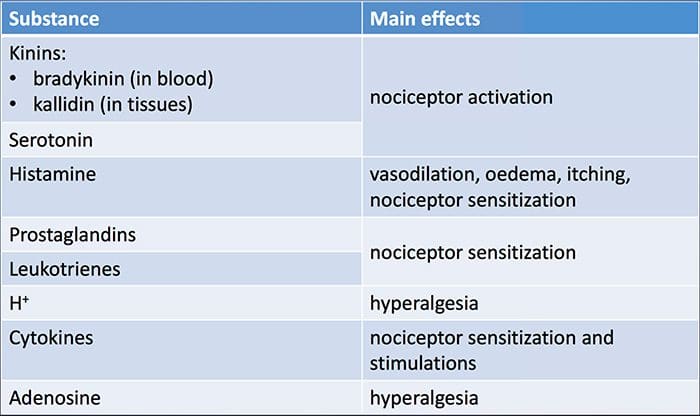
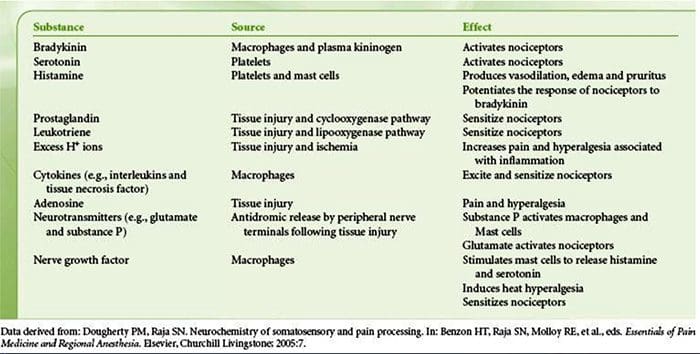
Vævsskade involverer en række inflammatoriske mediatorer, der frigøres af beskadigede celler, herunder bradykinin, histamin, 5-hydroxytryptamin, ATP, nitrogenoxid og visse ioner (K + og H +). Aktivering af arachidonsyrevejen fører til produktion af prostaglandiner, thromboxaner og leukotriener. Cytokiner, herunder interleukiner og tumornekrosefaktor? Og neurotrofiner, såsom nervevækstfaktor (NGF), frigøres også og er tæt involveret i lettelsen af inflammation.15 Andre stoffer såsom excitatoriske aminosyrer (glutamat) og opioider ( endothelin-1) er også blevet impliceret i den akutte inflammatoriske respons.16 17 Nogle af disse midler kan direkte aktivere nociceptorer, mens andre medfører rekruttering af andre celler, som derefter frigiver yderligere facilitatoriske agenser.18 Denne lokale proces resulterer i øget respons af nociceptive neuroner til deres normale input og / eller rekruttering af et svar på normalt undertærskelinput kaldes perifer sensibilisering . Figur 1 opsummerer nogle af de involverede nøglemekanismer.
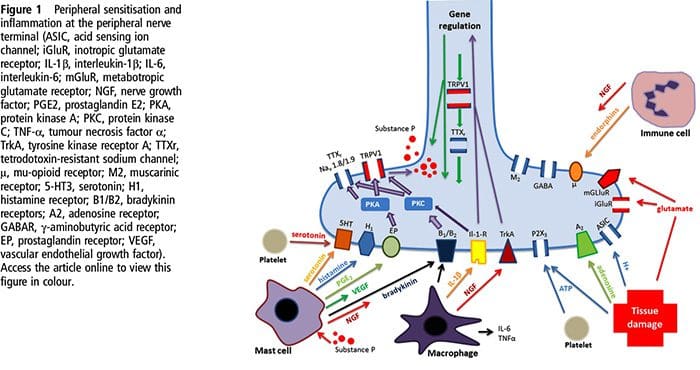 NGF og den transiente receptorpotentiale kationkanal-underfamilie V-medlem 1 (TRPV1) -receptor har et symbiotisk forhold, når det kommer til inflammation og nociceptorsensibilisering. Cytokiner produceret i betændt væv resulterer i en stigning i NGF-produktion. 19 NGF stimulerer frigivelsen af histamin og serotonin (5-HT3) af mastceller og sensibiliserer også nociceptorer og muligvis ændrer egenskaberne af A? fibre, således at en større andel bliver nociceptiv. TRPV1-receptoren er til stede i en subpopulation af primære afferente fibre og aktiveres af capsaicin, varme og protoner. TRPV1-receptoren syntetiseres i cellen af den afferente fiber og transporteres til både de perifere og centrale terminaler, hvor den bidrager til følsomheden af nociceptive afferenter. Betændelse resulterer i NGF-produktion perifert, som derefter binder til tyrosinkinasereceptor type 1-receptoren på nociceptorterminalerne, NGF transporteres derefter til cellelegemet, hvor det fører til en opregulering af TRPV1-transkription og følgelig øget nociceptor-følsomhed. 19 20 NGF og andre inflammatoriske mediatorer sensibiliserer også TRPV1 gennem en række forskellige sekundære messengerveje. Mange andre receptorer inklusive cholinerge receptorer, a-aminosmørsyre (GABA) receptorer og somatostatinreceptorer menes også at være involveret i perifer nociceptor-følsomhed.
NGF og den transiente receptorpotentiale kationkanal-underfamilie V-medlem 1 (TRPV1) -receptor har et symbiotisk forhold, når det kommer til inflammation og nociceptorsensibilisering. Cytokiner produceret i betændt væv resulterer i en stigning i NGF-produktion. 19 NGF stimulerer frigivelsen af histamin og serotonin (5-HT3) af mastceller og sensibiliserer også nociceptorer og muligvis ændrer egenskaberne af A? fibre, således at en større andel bliver nociceptiv. TRPV1-receptoren er til stede i en subpopulation af primære afferente fibre og aktiveres af capsaicin, varme og protoner. TRPV1-receptoren syntetiseres i cellen af den afferente fiber og transporteres til både de perifere og centrale terminaler, hvor den bidrager til følsomheden af nociceptive afferenter. Betændelse resulterer i NGF-produktion perifert, som derefter binder til tyrosinkinasereceptor type 1-receptoren på nociceptorterminalerne, NGF transporteres derefter til cellelegemet, hvor det fører til en opregulering af TRPV1-transkription og følgelig øget nociceptor-følsomhed. 19 20 NGF og andre inflammatoriske mediatorer sensibiliserer også TRPV1 gennem en række forskellige sekundære messengerveje. Mange andre receptorer inklusive cholinerge receptorer, a-aminosmørsyre (GABA) receptorer og somatostatinreceptorer menes også at være involveret i perifer nociceptor-følsomhed.
Et stort antal inflammatoriske mediatorer er specifikt blevet impliceret i smerter i skulder og rotatormanchet.21 25 Mens nogle kemiske mediatorer direkte aktiverer nociceptorer, fører de fleste til ændringer i selve sensorisk neuron snarere end direkte at aktivere den. Disse ændringer kan være tidlige posttranslationelle eller forsinkede transkriptionsafhængige. Eksempler på førstnævnte er ændringer i TRPV1-receptoren eller i spændingsstyrede ionkanaler, der skyldes phosphorylering af membranbundne proteiner. Eksempler på sidstnævnte inkluderer den NGF-inducerede stigning i TRV1-kanalproduktion og den calciuminducerede aktivering af intracellulære transkriptionsfaktorer.
Molecular Mechanisms Of Nociception
Følelsen af smerte advarer os om reel eller forestående skade og udløser passende beskyttende reaktioner. Desværre overlever smerter ofte dets anvendelighed som et advarselssystem og bliver i stedet kronisk og svækkende. Denne overgang til en kronisk fase involverer ændringer i rygmarven og hjernen, men der er også bemærkelsesværdig modulering, hvor smertebeskeder initieres - på niveauet for den primære sensoriske neuron. Bestræbelser på at bestemme, hvordan disse neuroner registrerer smerteproducerende stimuli af termisk, mekanisk eller kemisk karakter, har afsløret nye signalmekanismer og bragt os tættere på forståelsen af de molekylære begivenheder, der letter overgange fra akut til vedvarende smerte.
 Neocochemistry of Nociceptors
Neocochemistry of Nociceptors
Glutamat er den overvejende excitatoriske neurotransmitter i alle nociceptorer. Histokemiske undersøgelser af voksen DRG afslører dog to brede klasser af ikke-myelinerede C-fibre.
Kemiske transducere for at gøre smerten værre
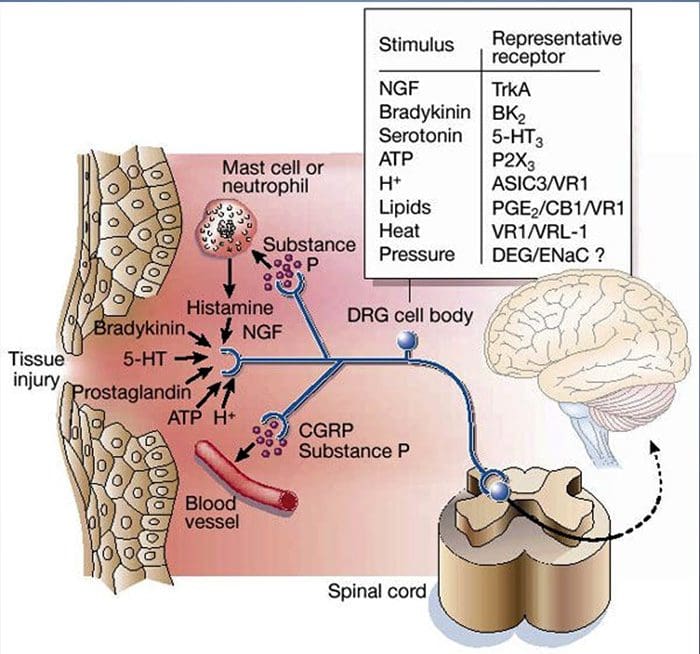
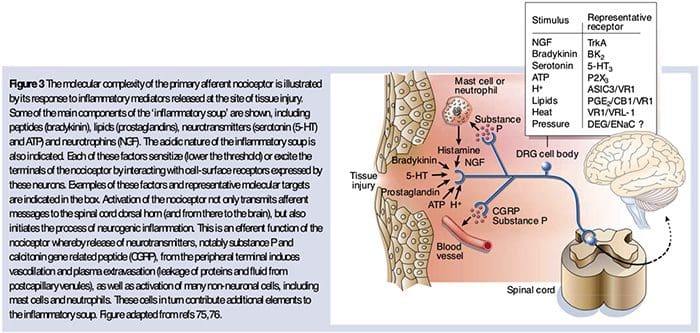
Som beskrevet ovenfor øger skaden vores smerteoplevelse ved at øge følsomheden af nociceptorer til både termiske og mekaniske stimuli. Dette fænomen resulterer dels af produktion og frigivelse af kemiske mediatorer fra den primære sensoriske terminal og fra ikke-neurale celler (fx fibroblaster, mastceller, neutrofiler og blodplader) i miljøet 36 (Fig. 3). Nogle komponenter i den inflammatoriske suppe (for eksempel protoner, ATP, serotonin eller lipider) kan ændre neuronal excitabilitet direkte ved at interagere med ionkanaler på nociceptoroverfladen, mens andre (for eksempel bradykinin og NGF) binder til metabotrope receptorer og formidle deres virkninger gennem anden-messenger signalering cascades11. Der er gjort betydelige fremskridt med forståelsen af biokemiske grundlag for sådanne modulerende mekanismer.
Ekstracellulære protoner og vævsacidose
Lokal vævsacidose er et kendetegnende fysiologisk respons på skade, og graden af forbundet smerte eller ubehag er godt korreleret med størrelsen af forsuring37. Anvendelse af syre (pH 5) til huden frembringer vedvarende udledninger i en tredjedel eller flere af polymodale nociceptorer, som inderverer det modtagelige felt 20.
 Cellular & Molecular Mechanisms of Pain
Cellular & Molecular Mechanisms of Pain
Abstrakt
Nervesystemet registrerer og fortolker en bred vifte af termiske og mekaniske stimuli samt miljømæssige og endogene kemiske irritationsmidler. Når de er intense, frembringer disse stimuli akut smerte, og i forbindelse med vedvarende skade udviser både perifere og centrale nervesystemets komponenter i smerteoverførselsvejen stor plasticitet, forstærker smertesignaler og producerer overfølsomhed. Når plasticitet letter beskyttelsesreflekser, kan det være gavnligt, men når ændringerne vedvarer, kan der opstå kronisk smerte. Genetiske, elektrofysiologiske og farmakologiske undersøgelser belyser de molekylære mekanismer, der ligger til grund for detektering, kodning og modulation af skadelige stimuli, som genererer smerte.
Introduktion: Akut versus vedvarende smerte
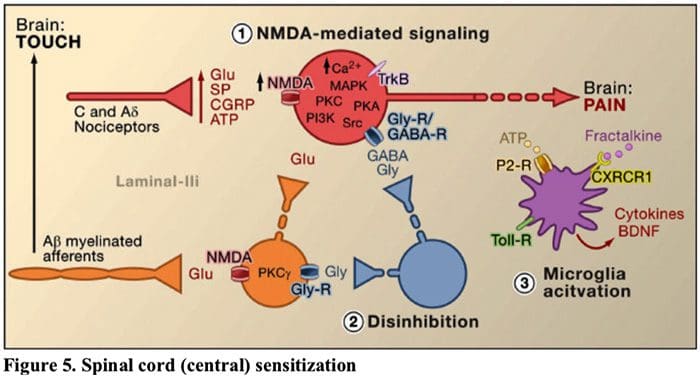 Figur 5. Spinal Cord (Central) Sensibilisering
Figur 5. Spinal Cord (Central) Sensibilisering
- Glutamat / NMDA-receptor-medieret sensibilisering.� Efter intens stimulering eller vedvarende skade, aktiveret C og A? nociceptorer frigiver en række neurotransmittere, herunder dlutamat, substans P, calcitoningenrelateret peptid (CGRP) og ATP, på outputneuroner i lamina I af det overfladiske dorsale horn (rødt). Som en konsekvens heraf kan normalt tavse NMDA-glutamatreceptorer placeret i den postsynaptiske neuron nu signalere, øge intracellulært calcium og aktivere en lang række calciumafhængige signalveje og sekundære budbringere, herunder mitogenaktiveret proteinkinase (MAPK), proteinkinase C (PKC) proteinkinase A (PKA) og Src. Denne kaskade af begivenheder vil øge excitabiliteten af outputneuronen og lette overførslen af smertemeddelelser til hjernen.
- Mangel på hæmninger.�Under normale omstændigheder frigiver hæmmende interneuroner (blå) kontinuerligt GABA og/eller glycin (Gly) for at mindske excitabiliteten af lamina I outputneuroner og modulere smertetransmission (hæmmende tonus). Men i tilfælde af skade kan denne hæmning gå tabt, hvilket resulterer i hyperalgesi. Derudover kan disinhibering muliggøre ikke-nociceptiv myeliniseret A? primære afferenter til at engagere smertetransmissionskredsløbet, således at normalt uskadelige stimuli nu opfattes som smertefulde. Dette sker til dels gennem desinhiberingen af excitatorisk PKC? udtrykker interneuroner i indre lamina II.
- Mikrogial aktivering.�Perifer nerveskade fremmer frigivelse af ATP og kemokin fractalkin, der vil stimulere mikrogliaceller. Især resulterer aktivering af purinerge, CX3CR1 og Toll-lignende receptorer på mikroglia (lilla) i frigivelsen af hjerneafledt neurotrofisk faktor (BDNF), som gennem aktivering af TrkB-receptorer udtrykt af lamina I outputneuroner fremmer øget excitabilitet og øget smerte som reaktion på både skadelig og uskadelig stimulering (det vil sige hyperalgesi og allodyni). Aktiverede mikroglia frigiver også et væld af cytokiner, såsom tumornekrosefaktor ? (TNF?), interleukin-1? og 6 (IL-1a, IL-6) og andre faktorer, der bidrager til central sensibilisering.
Den kemiske miljø af inflammation
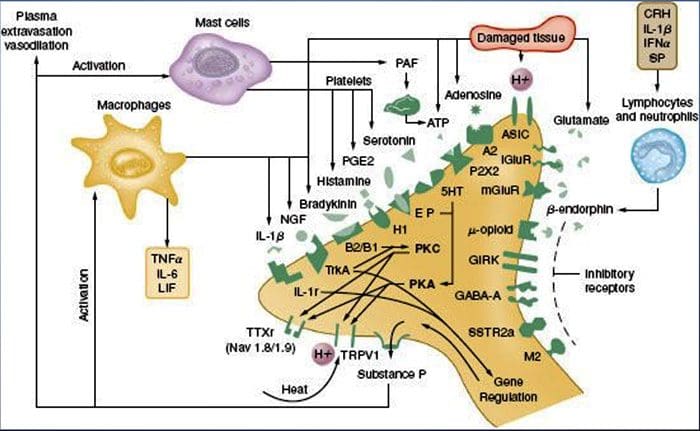
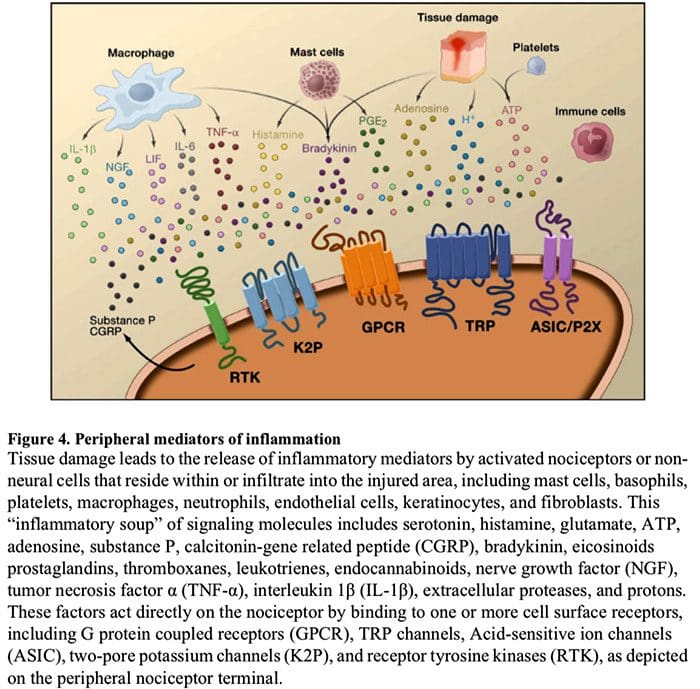
Perifer sensibilisering er mere almindeligt resultat af inflammationsassocierede ændringer i nervefiberens kemiske miljø (McMahon et al., 2008). Således ledsages vævsskade ofte af akkumulering af endogene faktorer frigivet fra aktiverede nociceptorer eller ikke-neurale celler, der opholder sig i eller infiltrerer i det skadede område (herunder mastceller, basofiler, blodplader, makrofager, neutrofiler, endotelceller, keratinocytter og fibroblaster). Kollektivt. disse faktorer, der betegnes som den 'inflammatoriske suppe', repræsenterer en bred vifte af signalmolekyler, herunder neurotransmittere, peptider (stof P, CGRP, bradykinin), eicosinoider og beslægtede lipider (prostaglandiner, thromboxaner, leukotriener, endocannabinoider), neurotrofiner, cytokiner og kemokiner såvel som ekstracellulære proteaser og protoner. Bemærkelsesværdigt udtrykker nociceptorer en eller flere celleoverfladereceptorer, der er i stand til at genkende og reagere på hver af disse proinflammatoriske eller pro-algesiske midler (figur 4). Sådanne interaktioner forbedrer nervefiberens spænding og øger dermed dens følsomhed over for temperatur eller berøring.
Utvivlsomt er den mest almindelige tilgang til reduktion af inflammatorisk smerte inhibering af syntese eller akkumulering af komponenter i den inflammatoriske suppe. Dette er bedst eksemplificeret ved ikke-steroide antiinflammatoriske lægemidler, såsom aspirin eller ibuprofen, som reducerer inflammatorisk smerte og hyperalgesi ved at hæmme cyclooxygenaser (Cox-1 og Cox-2) involveret i prostaglandinsyntese. En anden tilgang er at blokere virkningerne af inflammatoriske midler ved nociceptoren. Her fremhæver vi eksempler, der giver nyt indblik i cellulære mekanismer for perifert sensibilisering, eller som danner basis for nye terapeutiske strategier til behandling af inflammatorisk smerte.
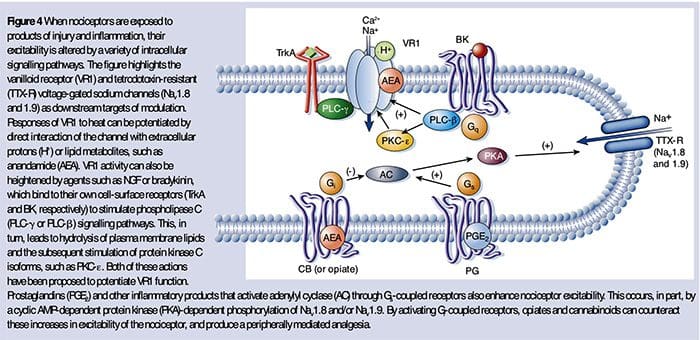
NGF er måske bedst kendt for sin rolle som en neurotrof faktor, der er nødvendig for overlevelse og udvikling af sensoriske neuroner under embryogenese, men hos voksne produceres NGF også i vævsskade og udgør en vigtig bestanddel af den inflammatoriske suppe (Ritner et al., 2009). Blandt de mange cellulære mål virker NGF direkte på peptidergiske C-fibernociceptorer, som udtrykker højaffinitets-NGF-receptor tyrosinkinasen, TrkA, såvel som den lave affinitets neurotrofinreceptor, p75 (Chao, 2003, Snider og McMahon, 1998). NGF producerer dyb overfølsomhed over for varme og mekaniske stimuli gennem to midlertidigt adskilte mekanismer. I begyndelsen aktiverer en NGF-TrkA-interaktion nedstrøms signalveje, herunder phospholipase C (PLC), mitogenaktiveret proteinkinase (MAPK) og phosphoinositid 3-kinase (PI3K). Dette resulterer i funktionel potensiering af målproteiner ved den perifere nociceptorterminal, især TRPV1, hvilket fører til en hurtig ændring i cellulær og adfærdsmæssig varmefølsomhed (Chuang et al., 2001).
Uafhængigt af deres pro-nociceptive mekanismer er interferering med neurotrofin- eller cytokinsignalering blevet en vigtig strategi til at kontrollere inflammatorisk sygdom eller resulterende smerte. Hovedtilgangen involverer blokering af NGF eller TNF-? virkning med et neutraliserende antistof. I tilfælde af TNF-a har dette været bemærkelsesværdigt effektivt i behandlingen af adskillige autoimmune sygdomme, herunder leddegigt, hvilket fører til dramatisk reduktion i både vævsdestruktion og ledsagende hyperalgesi (Atzeni et al., 2005). Fordi hovedvirkningerne af NGF på den voksne nociceptor forekommer i forbindelse med inflammation, er fordelen ved denne tilgang, at hyperalgesi vil falde uden at påvirke normal smerteopfattelse. Faktisk er anti-NGF-antistoffer i øjeblikket i kliniske forsøg til behandling af inflammatoriske smertesyndromer (Hefti et al., 2006).
Glutamat / NMDA-receptor-medieret sensibilisering
Akut smerte signaleres ved frigivelse af glutamat fra de centrale terminaler af nociceptorer, der genererer excitatoriske postsynaptiske strømme (EPSC'er) i andenordens dorsale hornneuroner. Dette sker primært ved aktivering af postsynaptiske AMPA- og kainat-subtyper af ionotrope glutamatreceptorer. Summation af sub-threshold-EPSC'er i den postsynaptiske neuron vil i sidste ende resultere i et actionpotentialeafbrænding og transmission af smertebeskeden til højere ordensneuroner.
Andre undersøgelser tyder på, at ændringer i projektionsnernen i sig selv bidrager til den uhæmmende proces. For eksempel nedbryder perifere nerveskader K + - Cl-co-transportøren KCC2, som er afgørende for at opretholde normale K + og Cl-gradienter over plasmamembranen (Coull et al., 2003). Nedregulerende KCC2, som udtrykkes i projektionsnekroner, resulterer i et skift i Cl-gradienten, således at aktivering af GABA-A-receptorer depolariseres, snarere end at hyperpolarisere lamina I-projektionsneuronerne. Dette vil igen forbedre excitabiliteten og øge smerteoverførslen. Faktisk inducerer farmakologisk blokade eller siRNA-medieret downregulering af KCC2 i rotten mekanisk allodyni.
kilder:
Hvorfor gør min skulder ondt? En gennemgang af det neuroanatomiske og biokemiske grundlag for skulder smerte
Benjamin John Floyd Dean, Stephen Edward Gwilym, Andrew Jonathan Carr
Cellulære og molekylære mekanismer af smerte
Allan I. Basbaum1, Diana M. Bautista2, Gre? Gory Scherrer1 og David Julius3
1Department of Anatomy, University of California, San Francisco 94158
2Department of Molecular and Cell Biology, University of California, Berkeley CA 94720 3Department of Physiology, University of California, San Francisco 94158
Molekylære mekanismer af nociception
David Julius * & Allan I. Basbaum
*Afdelingen for cellulær og molekylær farmakologi, og afdelingen for anatomi og fysiologi og WM Keck Foundation Center for Integrative Neuroscience, University of California San Francisco, San Francisco, Californien 94143, USA (e-mail: julius@socrates.ucsf.edu)
Oplysningerne heri om "Biokemi af smerte" er ikke beregnet til at erstatte et en-til-en-forhold med en kvalificeret sundhedsperson eller autoriseret læge og er ikke medicinsk rådgivning. Vi opfordrer dig til at træffe sundhedsbeslutninger baseret på din forskning og partnerskab med en kvalificeret sundhedsperson.
Bloginformation og diskussioner om omfang
Vores informationsomfang er begrænset til kiropraktik, muskuloskeletal, fysisk medicin, wellness, bidragende ætiologisk viscerosomatiske forstyrrelser inden for kliniske præsentationer, tilhørende somatovisceral refleks klinisk dynamik, subluksationskomplekser, følsomme helbredsproblemer og/eller funktionel medicin artikler, emner og diskussioner.
Vi giver og præsenterer klinisk samarbejde med specialister fra forskellige discipliner. Hver specialist er styret af deres faglige omfang af praksis og deres licensjurisdiktion. Vi bruger funktionelle sundheds- og velværeprotokoller til at behandle og understøtte pleje af skader eller lidelser i bevægeapparatet.
Vores videoer, indlæg, emner, emner og indsigt dækker kliniske forhold, problemstillinger og emner, der relaterer til og direkte eller indirekte understøtter vores kliniske anvendelsesområde.*
Vores kontor har med rimelighed forsøgt at give støttende citater og har identificeret den eller de relevante forskningsundersøgelser, der understøtter vores indlæg. Vi leverer kopier af understøttende forskningsundersøgelser tilgængelige for tilsynsråd og offentligheden efter anmodning.
Vi forstår, at vi dækker forhold, der kræver yderligere forklaring på, hvordan det kan hjælpe med en bestemt plejeplan eller behandlingsprotokol. derfor er du velkommen til at spørge for yderligere at diskutere emnet ovenfor Dr. Alex Jimenez, DC, eller kontakte os på 915-850-0900.
Vi er her for at hjælpe dig og din familie.
Blessings
Dr. Alex Jimenez A.D. MSACP, RN*, CCST, Ifmcp*, CIFM*, ATN*
Email: coach@elpasofunctionalmedicine.com
Licenseret som Doctor of Chiropractic (DC) i Texas & New Mexico*
Texas DC-licensnummer TX5807, New Mexico DC Licensnr. NM-DC2182
Licenseret som registreret sygeplejerske (RN*) in Florida
Florida-licens RN-licens # RN9617241 (Kontrol nr. 3558029)
Kompakt status: Multi-State Licens: Bemyndiget til at praktisere i 40 stater*
Dr. Alex Jimenez DC, MSACP, RN*CIFM*, IFMCP*, ATN*, CCST
Mit digitale visitkort







